
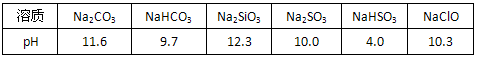
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:
 運用化學知識解決生產、生活中的有關問題備受關注.請回答下列問題:
運用化學知識解決生產、生活中的有關問題備受關注.請回答下列問題:| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
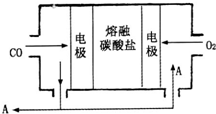 (2013?德州模擬)鈉及其化合物具有廣泛的用途.
(2013?德州模擬)鈉及其化合物具有廣泛的用途.
| ||
| ||
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 離子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 陽離子 | H+、Na+、Al3+、Ag+、Ba2+ |
| 陰離子 | OH-、Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com