
| 選用的儀器 | |||||
| 添加的藥品(或必要的操作) |
分析 (1)某純堿樣品中含有NaCl雜質,利用鹽酸和碳酸鈉反應生成二氧化碳氣體的原理設計,稱量一定量樣品于蒸發皿中稱量其質量,加入鹽酸到不再生成氣體為止,再稱量蒸發皿的質量,利用兩次質量差得到二氧化碳質量,結合碳元素守恒計算碳酸鈉的質量分數;
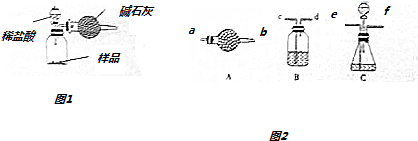
(2)如圖1所示的實驗裝置利用分液漏斗向廣口瓶中的樣品中加入鹽酸到不再生成氣體,利用堿石灰吸收生成的二氧化碳,稱量反應前后干燥管的質量得到二氧化碳氣體質量,結合碳元素守恒計算碳酸鈉質量分數;
(3)根據將裝置中生成的二氧化碳利用空氣趕走,保證生成的二氧化碳完全被堿石灰吸收原則進行選擇,空氣中二氧化碳需要通過氫氧化鈉溶液吸收,吸收二氧化碳前需要干燥,最后防止空氣進入干擾二氧化碳質量測定和吸收.
解答 解:(1)實驗只提供鹽酸、天平、蒸發皿、玻璃棒、鐵架臺(帶鐵夾,鐵圈)甲同學設計了一個方案,把蒸發皿放在鐵架臺的鐵圈上,稱量一定質量的樣品于蒸發皿中,稱量此時蒸發皿的質量,然后加入鹽酸中用玻璃棒攪拌到不再生成氣體為止,再稱量蒸發皿的質量,利用兩次稱量的質量差得到生成二氧化碳氣體的質量,結合碳元素守恒計算樣品中碳酸鈉的質量分數,反應的化學方程式為:Na2CO3+2HCl=2NaCl+CO2↑+H2O,
故答案為:Na2CO3+2HCl=2NaCl+CO2↑+H2O,把蒸發皿放在鐵架臺的鐵圈上,稱量一定質量的樣品于蒸發皿中,稱量此時蒸發皿的質量,然后加入鹽酸中用玻璃棒攪拌到不再生成氣體為止,再稱量蒸發皿的質量,利用兩次稱量的質量差得到生成二氧化碳氣體的質量,結合碳元素守恒計算樣品中碳酸鈉的質量分數;
(2)如圖1所示的實驗裝置利用分液漏斗向廣口瓶中的樣品中加入鹽酸到不再生成氣體,利用堿石灰吸收生成的二氧化碳,稱量反應前后干燥管的質量得到二氧化碳氣體質量,結合碳元素守恒計算碳酸鈉質量分數,(Na2CO3)=$\frac{(m_{2}-m_{1})×53}{m_{0}×22}$×100%,則m2-m1表示樣品中碳酸鈉和鹽酸反應生成的二氧化碳質量,如果不計稱量誤差,該同學的實驗結果也有誤差,生成的二氧化碳氣體中的水蒸氣被堿石灰吸收會導致二氧化碳氣體質量增大,干燥管和空氣直接相連會吸收空氣中的水蒸氣和二氧化碳也可以導致測定的二氧化碳質量增大,
故答案為:生成二氧化碳氣體的質量,有,偏大,生成的二氧化碳氣體中含水蒸氣,干燥管會吸收空氣中的水蒸氣、二氧化碳氣體;
(3)按照從左向右的順序,裝置分別是B、C、B、A、A,B中裝有氫氧化鈉溶液,將通入的空氣中的二氧化碳除掉,保證裝置的生成的二氧化碳完全被堿石灰吸收;
C裝置中分液漏斗中選用稀硫酸,避免揮發;B中裝有濃硫酸,用于干燥二氧化碳,避免水分干擾;A裝置中裝有堿石灰,用于測定生成的二氧化碳質量;A裝置裝有堿石灰,用于吸收空氣中的二氧化碳和水,避免影響A中質量,
故答案為:
| 選用的儀器 | B | C | B | A | A |
| 添加的藥品 (必要的操作) | 裝有氫氧化鈉溶液,從c通入空氣 | 分液漏斗裝稀硫酸,錐形瓶內裝樣品溶液 | 濃硫酸 | 堿石灰,反應前后分別稱量質量 | 堿石灰 |
點評 本題解答此類題型的關鍵是分析實驗目的和探究方法,實驗是通過生成的二氧化碳的質量來測定碳酸鈉樣品的成分含量,所以實驗的成敗在于收集的二氧化碳的質量是否準確,注意測定過程中的干擾問題,題目難度中等.


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:解答題
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | E | R | F | |||||
| 3 | A | C | D | H | I | G | ||
| 4 | B |
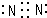 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
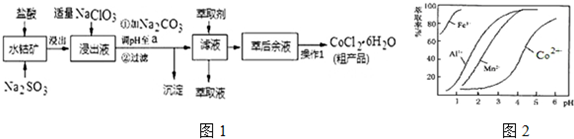
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 開始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
溫度/℃ 化合物 | 0 | 20 | 40 | 60 | 80 | 100 |
| NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
| ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
| 化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
| Ksp近似值 | 10-17 | 10-17 | 10-39 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
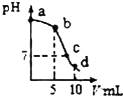 25℃時,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1鹽酸,溶液pH隨加入鹽酸的體積變化情況如如圖所示.,則下列說法不正確的是( )已知:Ka(HCN)=6.4×10-10.
25℃時,向10mL0.2mol•L-1NaCN溶液中加入0.2mol•L-1鹽酸,溶液pH隨加入鹽酸的體積變化情況如如圖所示.,則下列說法不正確的是( )已知:Ka(HCN)=6.4×10-10.| A. | a點時,CN-離子濃度大于其他點 | B. | b點時,c(HCN)>c(CN-) | ||
| C. | c點時,c(Na+)=c(Cl-)+c(CN-) | D. | d點時,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食醋 | B. | 白酒 | C. | 食鹽 | D. | 葡萄糖 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2O+H2O═2NaOH | B. | Zn+H2SO4(稀)═ZnSO4+H2↑ | ||
| C. | 2AgNO3═2Ag+2NO2↑+O2↑ | D. | 3NO2+H2O═2HNO3+NO |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用激光筆照射煮沸過的FeCl3溶液可觀察到明亮光路 | |
| B. | 大霧天氣用汽車遠光燈照射前方常出現明亮光路 | |
| C. | 明礬可用作凈水劑 | |
| D. | 臭氧、Cl2均可用于水的消毒凈化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | x+y<z | B. | 平衡向右移動 | C. | B的轉化率升高 | D. | C的體積分數降低 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com