
【題目】試用VSEPR理論判斷下列分子或離子的立體構型,并判斷中心原子的雜化類型:
(1)H2O____________形,雜化類型_________;
(2)CO32-__________形,雜化類型_________;
(3)SO32-__________形,雜化類型_________;
【答案】V形 sp3 平面三角形 sp2 三角錐形 sp3
【解析】
根據價層電子對互斥理論確定分子或離子空間構型,價層電子對個數n=σ鍵個數+孤電子對個數,σ鍵個數=配原子個數,孤電子對個數= ![]() (a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數。根據n值判斷雜化類型:一般有如下規律:當n=2,sp雜化;n=3,sp2雜化;n=4,sp3雜化,據此分析解答。
(a-xb),a指中心原子價電子個數,x指配原子個數,b指配原子形成穩定結構需要的電子個數。根據n值判斷雜化類型:一般有如下規律:當n=2,sp雜化;n=3,sp2雜化;n=4,sp3雜化,據此分析解答。
(1)H2O中價層電子對個數n=2+![]() (6-2×1)=4,含孤電子對數為2,中心原子采用sp3雜化,所以該分子為V型;
(6-2×1)=4,含孤電子對數為2,中心原子采用sp3雜化,所以該分子為V型;
(2)CO32-中價層電子對個數n=3+![]() (4+2-3×2)=3,含孤電子對數為0,中心原子采用sp2雜化,所以該分子為平面三角形;
(4+2-3×2)=3,含孤電子對數為0,中心原子采用sp2雜化,所以該分子為平面三角形;
(3)SO32-中價層電子對個數n=3+![]() (6+2-3×2)=4,含孤電子對數為1,中心原子采用sp3雜化,所以該分子為三角錐形。
(6+2-3×2)=4,含孤電子對數為1,中心原子采用sp3雜化,所以該分子為三角錐形。


科目:高中化學 來源: 題型:
【題目】如圖所示裝置中,K為開關,電極分別為Fe棒和C棒,電解質溶液為CuSO4溶液。
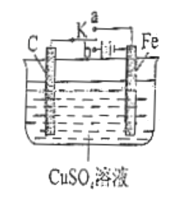
(1)當開關K置于a處時,該裝置為________________(填“原電池”或 “電解池”)。寫出Fe電極上的反應式____________________________。
(2)當開關K置于b處時,寫出C電極上的反應式________________________。
(3)當開關K置于b處時,工作一段時間,當某電極上析出3.2g Cu時溶液的pH為____________。 (溶液的體積為1L) 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用如圖所示裝置進行Fe與水蒸氣反應的實驗,下列有關說法不正確的是

A. 裝置A的作用是為實驗提供持續不斷的水蒸氣
B. 裝置B中反應的化學方程式是2Fe+3H2O![]() Fe2O3+3H2↑
Fe2O3+3H2↑
C. 裝置C中加入的固體干燥劑可能是堿石灰
D. 點燃D處的氣體前必須檢驗氣體的純度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某班同學用如下實驗探究Fe2+、Fe3+的性質。回答下列問題:
(1)分別取一定量硫酸鐵、硫酸亞鐵固體,均配制成100mL0.1mol/L的溶液。在配制FeSO4溶液時需加入少量鐵屑,其目的是__。
(2)甲組同學取2mLFeSO4溶液,加入幾滴氯水,再加入1滴KSCN溶液,溶液變紅,說明Cl2可將Fe2+氧化。FeSO4溶液與氯水反應的離子方程式為___。
(3)乙組同學認為甲組的實驗不夠嚴謹,該組同學在2mLFeSO4溶液中先加入0.5mL煤油,再于液面下依次加入幾滴氯水和1滴KSCN溶液,溶液變紅,煤油的作用是__。
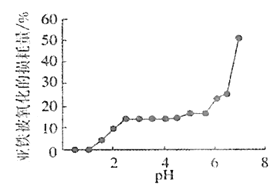
(4)丙組同學研究pH對FeSO4穩定性的影響,得到如圖所示結果,增強Fe2+穩定性的措施為__。(寫出一條即可)
(5)丁組同學為了探究Fe2(SO4)3與Cu的反應,做了如圖所示實驗:
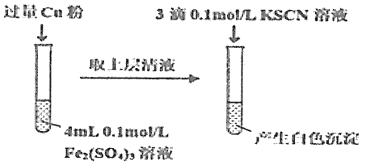
①Fe3+與Cu反應的離子方程式為__。
②為了探究白色沉淀產生的原因,同學們查閱資料得知:
i.CuSCN是難溶于水的白色固體;
ii.SCN的化學性質與I-相似;
ii.2Cu2++4I-=2CuI↓+I2。
填寫實驗方案:
實驗方案 | 現象 |
步驟1:取4mL0.2mol/L的FeSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 無明顯現象 |
步驟2:取4mL_mol/L的CuSO4溶液,向其中滴加3滴0.1mol/L的KSCN溶液。 | 產生白色沉淀 |
Cu2+與SCN-反應的離子方程式為__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列中心原子的雜化軌道類型和分子幾何構型不正確的是( )
A.PCl3中 P原子sp3雜化,為三角錐形
B.BCl3中B原子sp2雜化,為平面三角形
C.CS2中C原子sp雜化,為直線形
D.H2S中S原子sp雜化,為直線形
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NOx會造成大氣污染,在工業上采用多種方法進行處理。
I.氧化法:煙氣中的NO經O3預處理后轉化為NO2,再用CaSO3懸濁液吸收NO2。
已知:常溫下,CaSO4的沉淀溶解平衡常數數值為9.1×10-6,CaSO3的沉淀溶解平衡常數數值為3.1×10-7。
(1)NO與O3反應過程的能量變化如下:
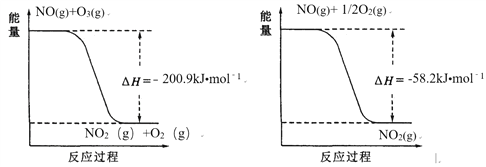
NO被O3氧化的總反應是化合反應,該反應的熱化學方程式為 ________。
(2)將CaSO3懸濁液靜置,取上層清液,測得pH約為8,用化學用語解釋其原因為________。
(3)用CaSO3懸濁液吸收NO2,將其轉化為HNO2,該反應的化學方程式為________。
(4)在實際吸收NO2的過程中,通過向CaSO3懸濁液中加入Na2SO4固體,提高NO2的吸收速率,從溶解平衡的角度解釋其原因:________。
II. 選擇性非催化還原法:該反應不使用催化劑,但必須在高溫有氧下利用NH3做還原劑與 NOx 進行選擇性反應:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同溫度(T)下,反應時間(t)與NO濃度的關系如右圖所示。
3N2 + 6H2O,不同溫度(T)下,反應時間(t)與NO濃度的關系如右圖所示。
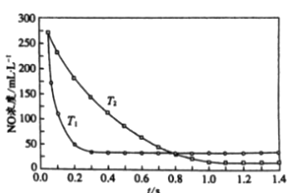
(5)判斷該反應為________(填“吸熱”或“放熱”)反應,說明理由:________ 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生活中的消毒劑酒精、含氯消毒劑、過氧乙酸等均可有效滅活病毒。病毒對紫外線和熱敏感。下列有關說法正確的是
A.84消毒液的主要有效成分是![]()
B.過氧乙酸![]() 可作為消毒劑,與苯酚混合使用殺菌能力更強
可作為消毒劑,與苯酚混合使用殺菌能力更強
C.加熱能殺死病毒是因為蛋白質受熱變性
D.聚丙烯樹脂是生產無紡布口罩的初始原料之一,聚丙烯可以使酸性高錳酸鉀溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物的天然提取和人工合成往往得到的是混合物,假設給你一種這樣的有機混合物讓你研究,一般要采取的幾個步驟是( )
A.分離、提純![]() 確定化學式
確定化學式![]() 確定最簡式
確定最簡式![]() 確定結構式
確定結構式
B.分離、提純![]() 確定最簡式
確定最簡式![]() 確定化學式
確定化學式![]() 確定結構式
確定結構式
C.分離、提純![]() 確定結構式
確定結構式![]() 確定最簡式
確定最簡式![]() 確定化學式
確定化學式
D.確定化學式![]() 確定最簡式
確定最簡式![]() 確定結構式
確定結構式![]() 分離、提純
分離、提純
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一種新型的合成氨的方法如圖所示,下列說法錯誤的是

A.反應①屬于“氮的固定”
B.反應②屬于非氧化還原反應
C.反應③可通過電解LiOH水溶液實現
D.上述三步循環的總反應方程式為2N2+6H2O=4NH3+3O2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com