
【題目】NOx會造成大氣污染,在工業上采用多種方法進行處理。
I.氧化法:煙氣中的NO經O3預處理后轉化為NO2,再用CaSO3懸濁液吸收NO2。
已知:常溫下,CaSO4的沉淀溶解平衡常數數值為9.1×10-6,CaSO3的沉淀溶解平衡常數數值為3.1×10-7。
(1)NO與O3反應過程的能量變化如下:
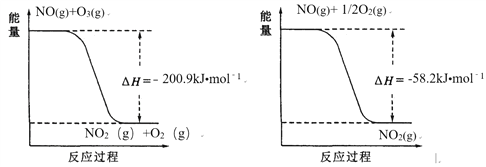
NO被O3氧化的總反應是化合反應,該反應的熱化學方程式為 ________。
(2)將CaSO3懸濁液靜置,取上層清液,測得pH約為8,用化學用語解釋其原因為________。
(3)用CaSO3懸濁液吸收NO2,將其轉化為HNO2,該反應的化學方程式為________。
(4)在實際吸收NO2的過程中,通過向CaSO3懸濁液中加入Na2SO4固體,提高NO2的吸收速率,從溶解平衡的角度解釋其原因:________。
II. 選擇性非催化還原法:該反應不使用催化劑,但必須在高溫有氧下利用NH3做還原劑與 NOx 進行選擇性反應:4NH3 + 4NO + O2 ![]() 3N2 + 6H2O,不同溫度(T)下,反應時間(t)與NO濃度的關系如右圖所示。
3N2 + 6H2O,不同溫度(T)下,反應時間(t)與NO濃度的關系如右圖所示。
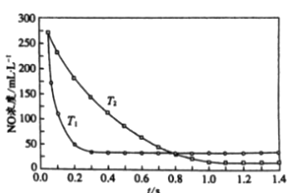
(5)判斷該反應為________(填“吸熱”或“放熱”)反應,說明理由:________ 。
【答案】 3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O
3NO2(g) ΔH= -317.3 kJmol﹣1 SO32- + H2O ![]() HSO3- + OH- CaSO3 + 2NO2 + H2O
HSO3- + OH- CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4 CaSO3濁液中存在:CaSO3(s)
2HNO2 + CaSO4 CaSO3濁液中存在:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固體,由于CaSO4的Ksp較小,SO42-與Ca2+結合生成CaSO4沉淀,c(Ca2+)減小,平衡正向移動,導致c(SO32-)增大,從而使NO2的吸收速率加快 放熱 由圖像中T1下反應先達平衡可推斷T1>T2,由T1(高溫)時NO的平衡濃度高可推斷正反應是放熱反應
Ca2+(aq) + SO32-(aq),加入Na2SO4固體,由于CaSO4的Ksp較小,SO42-與Ca2+結合生成CaSO4沉淀,c(Ca2+)減小,平衡正向移動,導致c(SO32-)增大,從而使NO2的吸收速率加快 放熱 由圖像中T1下反應先達平衡可推斷T1>T2,由T1(高溫)時NO的平衡濃度高可推斷正反應是放熱反應
【解析】I. (1). 由左圖可知,NO和O3反應生成NO2和O2的熱化學方程式為:NO(g)+O3(g)=NO2(g)+O2(g) △H=-200.9kJ/mol ①,由右圖可知,NO和O2反應生成NO2的熱化學方程式為:NO(g)+![]() O2(g)=NO2(g) △H=-58.2kJ/mol ②,①+2×②得3NO(g) + O3(g)
O2(g)=NO2(g) △H=-58.2kJ/mol ②,①+2×②得3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1,故答案為:3NO(g) + O3(g)
3NO2(g) ΔH= -317.3 kJmol﹣1,故答案為:3NO(g) + O3(g) ![]() 3NO2(g) ΔH= -317.3 kJmol﹣1;
3NO2(g) ΔH= -317.3 kJmol﹣1;
(2). CaSO3是強堿弱酸鹽,SO32-在溶液中發生水解反應:SO32- + H2O ![]() HSO3- + OH-,使溶液呈堿性,故答案為:SO32- + H2O
HSO3- + OH-,使溶液呈堿性,故答案為:SO32- + H2O ![]() HSO3- + OH-;
HSO3- + OH-;
(3). 用CaSO3懸濁液吸收NO2,將其轉化為HNO2,氮元素的化合價從+4價降低到+3價,則硫元素的化合價從+4價升高到+6價,SO32-生成SO42-,根據得失電子守恒和原子守恒,該反應的化學方程式為:CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4,故答案為:CaSO3 + 2NO2 + H2O
2HNO2 + CaSO4,故答案為:CaSO3 + 2NO2 + H2O ![]() 2HNO2 + CaSO4;
2HNO2 + CaSO4;
(4). 因CaSO3濁液中存在溶解平衡:CaSO3(s) ![]() Ca2+(aq) + SO32-(aq)
Ca2+(aq) + SO32-(aq)![]() Ca2+(aq) + SO32-(aq),加入Na2SO4固體,由于CaSO4的Ksp較小,SO42-與Ca2+結合生成CaSO4沉淀,c(Ca2+)減小,平衡正向移動,導致c(SO32-)增大,從而使NO2的吸收速率加快;
Ca2+(aq) + SO32-(aq),加入Na2SO4固體,由于CaSO4的Ksp較小,SO42-與Ca2+結合生成CaSO4沉淀,c(Ca2+)減小,平衡正向移動,導致c(SO32-)增大,從而使NO2的吸收速率加快;
II. (5). 據圖可知,在T1溫度下反應先達到平衡狀態,說明T1>T2,高溫時NO的平衡濃度高,說明該反應的正反應是放熱反應,故答案為:放熱;由圖像中T1下反應先達平衡可推斷T1>T2,由T1(高溫)時NO的平衡濃度高可推斷正反應是放熱反應。


科目:高中化學 來源: 題型:
【題目】電離常數(Ka或Kb)、溶度積常數(Ksp)是判斷物質性質的重要常數,下列關于這些常數的計算或運用正確的是( )
A. 某亞硫酸溶液pH=4.3,若忽略二級電離,則其一級電離平衡常數K1=1.0×10-8.60
B. Ka(HCN)<Ka(CH3COOH),說明同濃度時氫氰酸的酸性比醋酸強
C. Ksp(AgI)<Ksp(AgCl),向AgCl懸濁液中加入KI溶液會出現黃色沉淀
D. Ksp(AgCl)<Ksp(AgOH),說明AgOH和AgCl均不溶于稀硝酸
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A. 常溫下,向水中加入少量固體硫酸氫鈉,c(H+)增大,Kw變大
B. 0.1 mol·L-1的醋酸加水稀釋,c(CH3COOH)/c(CH3COO-)減小,但K不變。
C. 足量體積、pH均相同的醋酸和鹽酸完全溶解等量的鎂粉(少量)后者用時少
D. 25℃,在AgCl懸濁液中加入少量NaCl固體,c(Ag+)減小,Ksp(AgCl)減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
(Ⅰ)某探究小組用HNO3與大理石反應過程中質量減小的方法,研究影響反應速率的因素。所用HNO3濃度為1.00mol/L、2.00mol/L,大理石有細顆粒和粗顆粒兩種規格,實驗溫度為25℃、35℃,每次實驗HNO3的用量為25.00mL,大理石用量為10.00g。
請完成以下實驗設計表,并在實驗目的一欄中填空:
實驗 編號 | 溫度 (℃) | 大理石 規格 | HNO3濃度(mol/L) | 實驗目的 |
① | 25 | 粗顆粒 | 2.00 | (I)實驗①和②探究濃度對反應速率的影響; (II)實驗①和③探究溫度對反應速率的影響; (III)實驗①和④探究______________對反應速率的影響 |
② | 25 | 粗顆粒 | _______ | |
③ | _____ | 粗顆粒 | 2.00 | |
④ | 25 | 細顆粒 | 2.00 |
(Ⅱ)把2.5 mol A和2.5 mol B混合放入2 L密閉容器里,發生反應:3A(g)+B(g)![]() xC(g)+2D(g),經5 s后反應達平衡。在此5 s內C的平均反應速率為0.2 mol/(L·s),同時生成1 mol D。試求:
xC(g)+2D(g),經5 s后反應達平衡。在此5 s內C的平均反應速率為0.2 mol/(L·s),同時生成1 mol D。試求:
(1)達平衡時B的轉化率為_____________________。
(2)x的值為___________________。
(3)若溫度不變,達平衡時容器內氣體的壓強是反應前的____________倍。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向10.0 mL 0.10 mol/L氨水中滴入0.10 mol/L的鹽酸,溶液的pH與所加鹽酸的體積關系如圖所示(假設無氣體逸出)。下列有關敘述正確的是( )
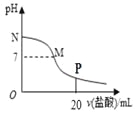
A. M~N間一定存在:c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B. M點對應的鹽酸體積為10.0mL
C. pH=7的溶液中:c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D. P點處的溶液中存在:2c(NH4+)+2c(NH3·H2O)=c(Cl-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】具有抗菌、消炎作用的黃酮醋酸類化合物L的合成路線如下圖所示:
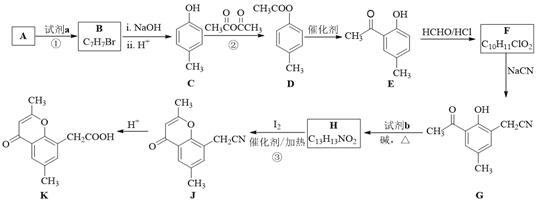
已知部分有機化合物轉化的反應式如下:
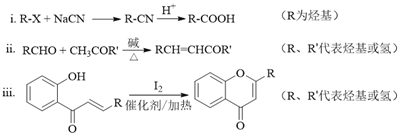
(1)A的分子式是C7H8,其結構簡式是______;A→B所屬的反應類型為______。
(2)C→D的化學方程式是______。
(3)寫出滿足下列條件的D的任意一種同分異構體的結構簡式:______。
a.能發生銀鏡反應
b.分子中含有酯基
c. 苯環上有兩個取代基,且苯環上的一氯代物有兩種
(4)F的結構簡式是______;試劑b是______。
(5)H與I2反應生成J和HI的化學方程式是______。
(6)以A和乙烯為起始原料,結合題中信息,選用必要的無機試劑合成苯乙酸乙酯(![]() ),參照下列模板寫出相應的合成路線。_____________
),參照下列模板寫出相應的合成路線。_____________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電浮選凝聚法是工業上采用的一種污水處理方法,即保持污水的pH在5.0~6.0之間,通過電解生成Fe(OH)3膠體,Fe(OH)3膠體具有吸附作用,可吸附水中的污物而使其沉淀下來,起到凈水的作用,其原理如圖所示。下列說法正確的是

A.石墨電極上發生氧化反應
B.根據圖示,物質A為CO2
C.為增強污水的導電能力,可向污水中加入適量乙醇
D.甲烷燃料電池中CO32-向空氣一極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】應對霧霾污染、改善空氣質量需要從多方面入手,如開發利用清潔能源。甲醇是一種可再生的清潔能源,具有廣闊的開發和應用前景。
Ⅰ.已知:①CH3OH(g)+H2O(l)=CO2(g)+3H2(g) ΔH=+93.0kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
③CH3OH(g)=CH3OH(l) ΔH=-38.19 kJ·mol-1
則表示CH3OH的燃燒熱的熱化學方程式為______________________________________________。
Ⅱ.在一定條件下用CO和H2合成CH3OH:CO(g)+2H2(g)![]() CH3OH(g),在2L恒容密閉容器中充入1mol CO和2molH2,在催化劑作用下充分反應。下圖表示平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化的平衡曲線。回答下列問題:
CH3OH(g),在2L恒容密閉容器中充入1mol CO和2molH2,在催化劑作用下充分反應。下圖表示平衡混合物中CH3OH的體積分數在不同壓強下隨溫度的變化的平衡曲線。回答下列問題:
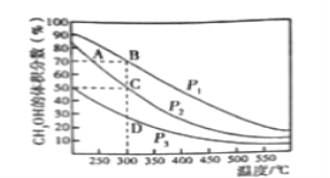
(1)該反應的反應熱ΔH_______0(填“>”或“<”),壓強的相對大小:p1_______p2(填“>”或“<”)。
(2)壓強為p2,溫度為300℃時,該反應的化學平衡常數K=________________。
(3)下列各項中,不能說明該反應已經達到平衡的是________________________________。
A.容器內氣體壓強不再變化 B.v(CO):c(H2):v(CO3OH)=1:2:1
C.容器內的密度不在變化 D.容器內混合氣體的平均相對分子質量不再變化
E.容器內各組分的質量分數不再變化
(4)某溫度下在保證H2濃度不變的情況下,增大容器的體積,平衡_________(填字母)。
A.向正反應方向移動 B.向逆反應方向移動 C.不移動
作出此判斷的依據是__________________________________________________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】H2X 和H2Y均為二元弱酸,常溫下,將NaOH 溶液分別加到H2X 和H2Y的溶液中,在不同pH 環境下不同形態的粒子(即酸、酸式酸根、酸根離子)的組成分數如圖所示:
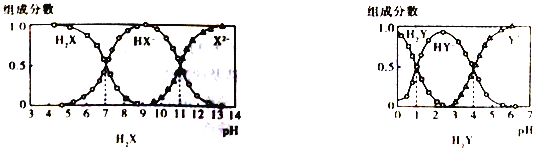
下列說法正確的是
A. 在pH=7的溶液中HX-、X2-、HY-和Y2-能大量共存
B. 向Na2X溶液中加入少量H2Y 溶液,發生反應:X2-+H2Y==HX-+HY-
C. 1L.0.1mol·L-1NaHY溶液中n(HY-)+2n(Y2-)+n(H2Y) =0.1mol
D. HX-的水解平衡常數為Kb=10-7
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com