
(17分)已知化學反應①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常數為K1;化學反應②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常數為K1;化學反應②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常數為K2,在溫度973 K和1 173 K情況下,K1、K2的值分別如下:
FeO(s)+H2(g),其平衡常數為K2,在溫度973 K和1 173 K情況下,K1、K2的值分別如下:
|
溫度 |
K1 |
K2 |
|
973 K |
1.47 |
2.38 |
|
1173 K |
2.15 |
1.67 |
(1)通過表格中的數值可以推斷:反應①是 (填“吸熱”或“放熱”)反應。
(2)現有反應③:CO2(g)+H2(g)  CO(g)+H2O(g),請你寫出該反應的平衡常數K3的數學表達式:K3=
,根據反應①與②可推導出K1、K2與K3之間的關系式
,據此關系式及上表數據,也能推斷出反應③是
(填“吸熱”或“放熱”)反應。
CO(g)+H2O(g),請你寫出該反應的平衡常數K3的數學表達式:K3=
,根據反應①與②可推導出K1、K2與K3之間的關系式
,據此關系式及上表數據,也能推斷出反應③是
(填“吸熱”或“放熱”)反應。
(3)要使反應③在一定條件下建立的平衡向正反應方向移動同時υ正增大可采取的措施
有 (填寫字母序號)。
A.縮小反應容器的容積 B.擴大反應容器的容積
C.升高溫度 D.使用合適的催化劑 E.設法減小平衡體系中的CO的濃度
(4)圖甲、乙分別表示反應③在t1時刻達到平衡,在t2時刻因改變某個條件而發生變化的情況:
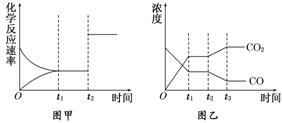
①圖甲中t2時刻發生改變的條件是 。②圖乙中t2時刻發生改變的條件是 。
(5)在830℃溫度下,反應③的K值為1,在2 L的密閉容器中,加入1 mol CO2和3 mol H2充分反應達平衡時,CO平衡濃度為 mol/L。H2轉化率 。若向容器中再加入1 mol CO2和3 mol H2 達到平衡后CO平衡濃度 mol/L ,CO2體積分數
 新思維假期作業暑假吉林大學出版社系列答案
新思維假期作業暑假吉林大學出版社系列答案 藍天教育暑假優化學習系列答案
藍天教育暑假優化學習系列答案科目:高中化學 來源: 題型:
 2NH3是工業上合成氨的重要反應.
2NH3是工業上合成氨的重要反應.
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| [CO][H2O] |
| [H2][CO2] |
| [CO][H2O] |
| [H2][CO2] |
| K1 |
| K2 |
| K1 |
| K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| 溫度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化學 來源:2014屆浙江臨海市高一下學期期末模擬化學試卷(解析版) 題型:填空題
(8分)某研究性學習小組為探究純鐵與鹽酸反應,取同質量、同體積的鋅片、同濃度鹽酸做了下列平行實驗:

實驗①:把純鐵片投入到盛有稀鹽酸的試管中,發現氫氣發生的速率變化如圖所示:
實驗②:在鹽酸中滴入幾滴CuCl2溶液,生成氫氣速率加快。
試回答下列問題:
(1)試分析實驗①中t1~t2速率變化的主要原因是 ,t2~t3速率變化的主要原因是 。
(2)若要加快化學反應速率,除實驗②的方法外,還可以采取哪些措施?(至少寫兩點)
、
(3)某同學認為實驗②反應速率加快的主要原因是因為形成了原電池,你認為是否正確?
(填“正確”或“不正確”)。請選擇下列相應的a或b作答。
a、若不正確,請說明原因:
b、若正確則寫出實驗②中原電池的正、負極電極反應式。
(4)已知熱化學方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的鐵完全反應后放出的熱量為 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com