
| 溫度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K1 |
| K2 |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K(CO).C(H2O) |
| C(CO2).C(H2) |
| K1 |
| K2 |
| K1 |
| K2 |


 世紀(jì)百通優(yōu)練測系列答案
世紀(jì)百通優(yōu)練測系列答案 百分學(xué)生作業(yè)本題練王系列答案
百分學(xué)生作業(yè)本題練王系列答案
| 年級 | 高中課程 | 年級 | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來源: 題型:
 2NH3是工業(yè)上合成氨的重要反應(yīng).
2NH3是工業(yè)上合成氨的重要反應(yīng).
 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol 2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol
2NH3(g)△H=2(E1-E3)或-2(E3-E1)kg/mol| 16 |
| a2 |
| 16 |
| a2 |
查看答案和解析>>
科目:高中化學(xué) 來源: 題型:
| 溫度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
| [CO][H2O] |
| [H2][CO2] |
| [CO][H2O] |
| [H2][CO2] |
| K1 |
| K2 |
| K1 |
| K2 |
查看答案和解析>>
科目:高中化學(xué) 來源:2014屆浙江臨海市高一下學(xué)期期末模擬化學(xué)試卷(解析版) 題型:填空題
(8分)某研究性學(xué)習(xí)小組為探究純鐵與鹽酸反應(yīng),取同質(zhì)量、同體積的鋅片、同濃度鹽酸做了下列平行實(shí)驗(yàn):

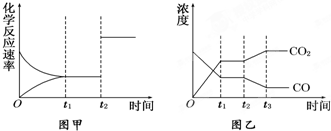
實(shí)驗(yàn)①:把純鐵片投入到盛有稀鹽酸的試管中,發(fā)現(xiàn)氫氣發(fā)生的速率變化如圖所示:
實(shí)驗(yàn)②:在鹽酸中滴入幾滴CuCl2溶液,生成氫氣速率加快。
試回答下列問題:
(1)試分析實(shí)驗(yàn)①中t1~t2速率變化的主要原因是 ,t2~t3速率變化的主要原因是 。
(2)若要加快化學(xué)反應(yīng)速率,除實(shí)驗(yàn)②的方法外,還可以采取哪些措施?(至少寫兩點(diǎn))
、
(3)某同學(xué)認(rèn)為實(shí)驗(yàn)②反應(yīng)速率加快的主要原因是因?yàn)樾纬闪嗽姵兀阏J(rèn)為是否正確?
(填“正確”或“不正確”)。請選擇下列相應(yīng)的a或b作答。
a、若不正確,請說明原因:
b、若正確則寫出實(shí)驗(yàn)②中原電池的正、負(fù)極電極反應(yīng)式。
(4)已知熱化學(xué)方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的鐵完全反應(yīng)后放出的熱量為 。
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com