
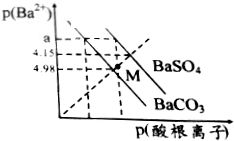
 已知:p(Ba2+)=-lgc(Ba2+),p(酸根離子)=-lgc(酸根離子),酸根離子為SO42-或CO32-.某溫度下BaSO4、BaCO3的沉淀溶解關系如圖所示,下列敘述正確的是( )
已知:p(Ba2+)=-lgc(Ba2+),p(酸根離子)=-lgc(酸根離子),酸根離子為SO42-或CO32-.某溫度下BaSO4、BaCO3的沉淀溶解關系如圖所示,下列敘述正確的是( )| A. | p(Ba2+)=a時,溶液中所含的c(SO42-)>c(CO32-) | |
| B. | M點對應溶液中的Ba2+、CO32-能形成BaCO3沉淀 | |
| C. | 由圖可知該溫度下,KSP(BaSO4)<KSP(BaCO3) | |
| D. | BaSO4淀不能轉化為BaCO3沉淀 |
分析 A.p(酸根離子)越大,酸根離子的濃度越小;
B.M點不在平衡線上,是不飽和溶液;
C.a點對鋇離子濃度相同,兩種酸根離子濃度不同;
D.當硫酸鋇懸濁液中碳酸根離子濃度足夠大時,BaSO4淀能轉化為BaCO3沉淀.
解答 解:A.p(酸根離子)越大,酸根離子的濃度越小,則p(Ba2+)=a時,溶液中所含的c(SO42-)<c(CO32-),故A錯誤;
B.M點不在平衡線上,p(Ba2+)與p(SO42-)的值均大于平衡線上的值,值越大,濃度越小,所以是不飽和溶液,故B錯誤;
C.a點對鋇離子濃度相同,兩種酸根離子濃度不同,而且c(SO42-)<c(CO32-),所以KSP(BaSO4)<KSP(BaCO3),故C正確;
D.硫酸鋇懸濁液中存在鋇離子,加入足量的碳酸根離子,當c(CO32-)×c(Ba2+)>KSP(BaCO3)時,會有BaCO3沉淀生成,所以硫酸鋇懸濁液中碳酸根離子濃度足夠大時,BaSO4淀能轉化為BaCO3沉淀,故D錯誤.
故選C.
點評 本題考查沉淀溶解平衡,題目難度中等,注意理解難溶電解質在水中的沉淀溶解平衡特點,正確理解和掌握溶度積KSP的概念.p(Ba2+)的值越大,鋇離子濃度越小,是解題關鍵.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:解答題
 為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.
為有效控制霧霾,各地積極采取措施改善大氣質量.有效控制空氣中氮氧化物、碳氧化物和硫氧化物顯得尤為重要.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2+、Al3+、SO42-、H+ | B. | Ba2+、Na+、Cl-、SO42- | ||
| C. | Mg2+、H+、SO42-、HCO3- | D. | Fe3+、Na+、SCN-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 90和18 | B. | 88和20 | C. | 90和20 | D. | 88和18 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgCl的沉淀生成和溶解不斷進行,但速率不相等 | |
| B. | AgCl難溶于水,溶液中沒有Ag+和Cl- | |
| C. | 升高溫度,AgCl的溶解度增大 | |
| D. | 向平衡體系中加入NaCl固體,AgCl的溶解度變小 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com