
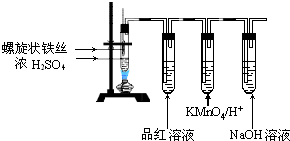
分析 (1)在常溫下鐵在濃硫酸中發生鈍化;
(2)根據二氧化硫具有漂白性的知識來回答;
(3)金屬鐵可以和稀硫酸反應還可以和三價鐵反應;
(4)溶液中加硫氰化鉀溶液,不變紅色,說明沒有三價鐵離子,再加氯氣變紅色說明含有亞鐵離子;
解答 解:(1)常溫下將Fe絲插入硫酸中會有氣泡產生,說明發生了反應,但一會兒后即停止,說明Fe在硫酸中發生了鈍化,阻止了反應的進一步進行,
故答案為:在常溫下鐵在濃硫酸中發生鈍化;
(2)Fe與濃H2SO4反應可能是濃H2SO4強氧化性或是發生置換反應生成H2,則實驗現象品紅溶液褪色說明產生的是SO2氣體,故答案為:生成的二氧化硫具有漂白性;
(3)溶液變為淺綠色說明產生了Fe2+,一種可能是Fe與H2SO4反應生成FeSO4,也存在Fe3+離子轉化為Fe2+,故答案為:Fe+2 H+=Fe2++H2,Fe+2Fe3+=3Fe2+;
(4)取適量反應后的溶液放入試管中,加入KSCN溶液無明顯現象,再加入少量氯水,溶液變紅則證明溶液中含有Fe2+但不含Fe3+;
故答案為:取適量反應后的溶液放入試管中,加入KSCN溶液無明顯現象,再加入少量氯水,溶液變紅則證明溶液中含有Fe2+但不含Fe3+.
點評 本題考查了實驗探究Fe和H2SO4反應的過程,題目難度中等,側重于考查學生的實驗操作和處理實驗數據能力,明確反應原理和有關物質的性質是解題的關鍵.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗步驟 | 預期現象與結論 |
| 步驟1: | 部分固體不溶解 |
| 步驟2: | |
| 步驟3:繼續步驟2中的(2),進行固液分離,用蒸餾水洗滌固體至洗滌液無色.取少量固體于試管中,滴加過量HCl后,靜置,取上層清液,滴加適量H2O2,充分振蕩后滴加KSCN. |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 加入較多NaHSO4的溶液中:Fe3+、Cl-、NO3-、Na+ | |
| B. | 通入大量CO2氣體的溶液中:Na+、Ba2+、Cl-、NO3- | |
| C. | 通入大量NH3的溶液中:Ca2+、Na+、HCO3-、Cl- | |
| D. | 通入大量SO2氣體的溶液中:Na+、SO32-、NH4+、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com