
【題目】制燒堿所用鹽水需兩次精制。第一次精制主要是用沉淀法除去粗鹽水中Ca2+、Mg2+、Fe3+、SO![]() 等離子,過程如下:
等離子,過程如下:
Ⅰ. 向粗鹽水中加入過量BaCl2溶液,過濾;
Ⅱ. 向所得濾液中加入過量Na2CO3溶液,過濾;
Ⅲ. 濾液用鹽酸調節pH,獲得一次精制鹽水。
(1)過程Ⅰ除去的離子是______。
(2)過程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
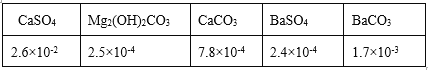
①檢測Fe3+是否除盡的方法是______。
②過程Ⅰ選用BaCl2而不選用CaCl2,運用表中數據解釋原因______。
③除去Mg2+的離子方程式是______。
④檢測Ca2+、Mg2+、Ba2+是否除盡時,只需檢測Ba2+即可,原因是_____。
(3)第二次精制要除去微量的I-、IO![]() 、NH
、NH![]() 、Ca2+、Mg2+,流程示意如下:
、Ca2+、Mg2+,流程示意如下:
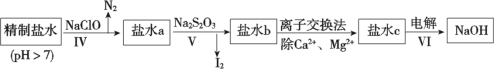
① 過程Ⅳ除去的離子是______。
② 鹽水b中含有SO![]() 。Na2S2O3將IO
。Na2S2O3將IO![]() 還原為I2的離子方程式是________ 。
還原為I2的離子方程式是________ 。
③ 過程VI中,在電解槽的陽極發生反應的電極方程式是:_________________。
【答案】SO![]() 取少量過程II后的濾液于試管中,滴加幾滴KSCN 溶液,若溶液不變紅,說明Fe 3+已除盡;反之沒除盡 BaSO4的溶解度比CaSO4的小,可將SO
取少量過程II后的濾液于試管中,滴加幾滴KSCN 溶液,若溶液不變紅,說明Fe 3+已除盡;反之沒除盡 BaSO4的溶解度比CaSO4的小,可將SO![]() 沉淀更完全 2Mg2+ + 2CO
沉淀更完全 2Mg2+ + 2CO![]() + H2O = Mg2(OH)2CO3↓+ CO2↑ 在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+ 和Ca2+也沉淀完全 NH
+ H2O = Mg2(OH)2CO3↓+ CO2↑ 在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+ 和Ca2+也沉淀完全 NH![]() 、I- 5S2O
、I- 5S2O![]() + 8IO
+ 8IO![]() + 2OH- =4I2 + 10SO
+ 2OH- =4I2 + 10SO![]() + H2O 2 Cl -- 2e- = Cl2↑
+ H2O 2 Cl -- 2e- = Cl2↑
【解析】
第一次精制:向粗鹽水中加入過量BaCl2溶液,Ba2+與SO![]() 得到BaSO4沉淀,過濾,除去BaSO4沉淀,向所得濾液中加入過量Na2CO3溶液,除去Ca2+、Mg2+、Fe3+和過量的Ba2+,過濾后,用鹽酸調節pH,除去過量的碳酸鈉,得到精制鹽水,結合表格數據分析解答(1)和(2);
得到BaSO4沉淀,過濾,除去BaSO4沉淀,向所得濾液中加入過量Na2CO3溶液,除去Ca2+、Mg2+、Fe3+和過量的Ba2+,過濾后,用鹽酸調節pH,除去過量的碳酸鈉,得到精制鹽水,結合表格數據分析解答(1)和(2);
第二次精制:向第一次精制鹽水(雜質離子為I-、IO![]() 、NH
、NH![]() 、Ca2+、Mg2+)中加入NaClO,NaClO具有氧化性,將I-氧化為I2、NH
、Ca2+、Mg2+)中加入NaClO,NaClO具有氧化性,將I-氧化為I2、NH![]() 氧化為N2,再加入Na2S2O3,將IO
氧化為N2,再加入Na2S2O3,將IO![]() 還原為I2,分離出I2后,通過離子交換法除去Ca2+、Mg2+,電解剩余溶液(硫酸鈉和氯化鈉的混合溶液)得到NaOH,據此分析解答(3)。
還原為I2,分離出I2后,通過離子交換法除去Ca2+、Mg2+,電解剩余溶液(硫酸鈉和氯化鈉的混合溶液)得到NaOH,據此分析解答(3)。
(1)向粗鹽水中加入過量BaCl2溶液,Ba2+與SO![]() 得到BaSO4沉淀,過濾,除去SO
得到BaSO4沉淀,過濾,除去SO![]() ,故答案為:SO
,故答案為:SO![]() ;
;
(2) ①Fe3+能夠使KSCN 溶液變紅,因此檢測Fe3+是否除盡的方法是取少量過程II后的濾液于試管中,滴加幾滴KSCN 溶液,若溶液不變紅,說明Fe 3+已除盡;反之沒除盡,故答案為:取少量過程II后的濾液于試管中,滴加幾滴KSCN 溶液,若溶液不變紅,說明Fe 3+已除盡;反之沒除盡;
②根據表格數據可知,BaSO4![]() 沉淀更完全,故過程Ⅰ選用的是BaCl2而不選用CaCl2,故答案為:BaSO4的溶解度比CaSO4的小,可將SO
沉淀更完全,故過程Ⅰ選用的是BaCl2而不選用CaCl2,故答案為:BaSO4的溶解度比CaSO4的小,可將SO![]() 沉淀更完全;
沉淀更完全;
③Mg2+與CO![]() 生成Mg2(OH)2CO3和二氧化碳,離子方程式為:2Mg2++2CO
生成Mg2(OH)2CO3和二氧化碳,離子方程式為:2Mg2++2CO![]() +H2O=Mg2(OH)2CO3↓+CO2↑,故答案為:2Mg2++2CO
+H2O=Mg2(OH)2CO3↓+CO2↑,故答案為:2Mg2++2CO![]() +H2O=Mg2(OH)2CO3↓+CO2↑;
+H2O=Mg2(OH)2CO3↓+CO2↑;
④Ca2+、Mg2+、Ba2+以CaCO3、Mg2(OH)2CO3、BaCO3的形式除去,根據溶解度小的物質沉淀完全后溶解度大的才開始沉淀,由表格數據可知,碳酸鋇的溶解度最大,若鋇離子沉淀完全,則說明鎂離子和鈣離子也沉淀完全,故檢測Ca2+、Mg2+、Ba2+是否除盡時,只需檢測Ba2+即可,故答案為:在BaCO3、CaCO3、Mg2(OH)2CO3 中,BaCO3的溶解度最大,若Ba2+沉淀完全,則說明Mg2+和Ca2+也沉淀完全;
(3)①NaClO具有強氧化性,能將I-氧化,根據流程可知NH![]() 被氧化為N2,故過程Ⅳ除去的離子是NH
被氧化為N2,故過程Ⅳ除去的離子是NH![]() 、I-,故答案為:NH
、I-,故答案為:NH![]() 、I-;
、I-;
②Na2S2O3將IO![]() 還原為I2,自身被氧化為SO
還原為I2,自身被氧化為SO![]() ,反應的離子方程式為:5S2O
,反應的離子方程式為:5S2O![]() +8IO
+8IO![]() +2OH-═4I2+10SO
+2OH-═4I2+10SO![]() +H2O,故答案為:5S2O
+H2O,故答案為:5S2O![]() +8IO
+8IO![]() +2OH-═4I2+10SO
+2OH-═4I2+10SO![]() +H2O;
+H2O;
③ 過程VI中,電解硫酸鈉和氯化鈉的混合溶液生成氫氧化鈉、氫氣和氯氣,在電解槽的陽極發生氧化反應,陽極的電極反應式為2 Cl -- 2e- = Cl2↑,故答案為:2 Cl- - 2e-= Cl2↑。


科目:高中化學 來源: 題型:
【題目】Fe、Cu、Cr都是第四周期過渡元素,回答下列問題。
(1)FeCl3是一種常用的凈水劑,氯元素的原子核外有____種不同運動狀態的電子;有___種不同能級的電子,基態Fe3+的電子排布式為___。
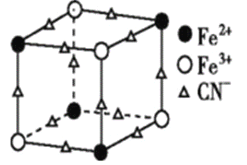
(2)實驗室中可用KSCN或K4[Fe(CN)6]來檢驗Fe3+。FeCl3與KSCN溶液混合,可得到配位數為5的配合物的化學式是____;K4[Fe(CN)6]與Fe3+反應可得到一種藍色沉淀KFe[Fe(CN)6],該物質晶胞的![]() 結構如圖所示(K+未畫出),則一個晶胞中的K+個數為 ___。
結構如圖所示(K+未畫出),則一個晶胞中的K+個數為 ___。
(3)Cu2+能與乙二胺(H2N-CH2-CH2-NH2)形成配離子。該配離子中含有的化學鍵類型有 __ (填字母)
a.配位鍵 b.極性鍵 c.離子鍵 d.非極性鍵,
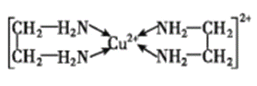
乙二胺中共有____個σ鍵,C原子的雜化方式為 ___。
(4)金屬銅的晶胞為面心立方最密堆積,邊長為361pm。又知銅的密度為9.0g·cm-3,則銅原子的直徑約為____pm。
(5)Cr是周期表中第ⅥB族元素,化合價可以是0~+6的整數價態。回答下列問題。某化合物的化學式為Na3CrO8,其陰離子結構可表示為![]() ,則Cr的化合價為____。CrO42-呈四面體構型,結構為
,則Cr的化合價為____。CrO42-呈四面體構型,結構為![]() ,Cr2O72-由兩個CrO42-四面體組成,這兩個CrO42-四面體通過共用一個頂角氧原子彼此連接,結構為
,Cr2O72-由兩個CrO42-四面體組成,這兩個CrO42-四面體通過共用一個頂角氧原子彼此連接,結構為![]() 。則由n(n>1)個CrO42-通過頂角氧原子連續的鏈式結構的化學式為____。
。則由n(n>1)個CrO42-通過頂角氧原子連續的鏈式結構的化學式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】酯類化合物與格氏試劑(RMgX,X=Cl、Br、I)的反應是合成叔醇類化合物的重要方法,可用于制備含氧多官能團化合物。化合物F的合成路線如圖:
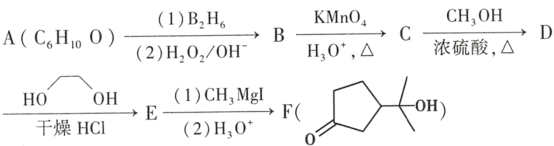
已知:
① RCH=CH2 ![]() RCH2CH2OH
RCH2CH2OH
②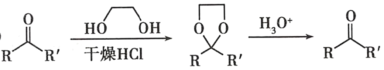
③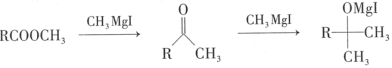
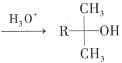
(1)A的結構簡式為_____。
(2)B→C的反應類型為_____。
(3)C中官能團的名稱為_____。
(4)C→D的化學方程式為_____。
(5)寫出符合下列條件的D的同分異構體_____(填結構簡式,不考慮立體異構)。
①含有五元環碳環結構;
②能與NaHCO3溶液反應放出CO2氣體;
③能發生銀鏡反應。
(6)D→E的目的是_____。
(7)已知羥基能與格氏試劑發生反應。寫出以 ![]() 、CH3OH 和格氏試劑為原料制備
、CH3OH 和格氏試劑為原料制備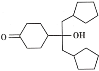 的合成路線(其他試劑任選)_____。
的合成路線(其他試劑任選)_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列關于 的說法,正確的是( )
的說法,正確的是( )
A.該物質可由n個單體分子通過縮聚反應生成
B.![]() 該物質完全燃燒,生成33.6 L(標準狀況)的
該物質完全燃燒,生成33.6 L(標準狀況)的![]()
C.該物質在酸性條件下水解產物之一可作汽車發動機的抗凍劑
D.![]() 該物質與足量
該物質與足量![]() 溶液反應,最多可消耗
溶液反應,最多可消耗![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】不能正確表示下列變化的離子方程式是
A.BaCO3溶于鹽酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.FeCl3溶液腐蝕銅板:2Fe3++Cu=2Fe2++Cu2+
C.苯酚鈉溶液中通入少量CO2:2![]() +CO2+H2O=2
+CO2+H2O=2![]() +CO32—
+CO32—
D.醋酸鈉水解:CH3COO+H2O![]() CH3COOH+OH
CH3COOH+OH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國城市為了減少燃煤造成的大氣污染,對民用燃料煤進行了多方面的改進。
(1)為了除去煤中的含硫化合物,可采用FeCl3脫硫,即用FeCl3溶液浸洗煤粉,發生如下反應:FeS2+14FeCl3+8H2O=2FeSO4+13FeCl2+16HCl。為了充分利用Fe2+并減少HCl污染,可利用工業廢鐵屑和氯氣與廢液重新作用生成FeCl3的方法。請寫出這一過程中有關的離子方程式:___________________________________。
(2)另一種方法是采用固硫法,即在燃煤中加入生石灰,使含硫煤在燃燒時生成的SO2不能逸出而進入爐渣中,試用化學方程式表示這一“固硫”過程:_______________________________。
(3)某城市采用了以油制氣代替煤作民用燃料的做法。油制氣的主要成分是丙烷,寫出其燃燒的化學方程式:________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法不正確的是( )
A.![]() 的溶液不一定呈堿性
的溶液不一定呈堿性
B.中和pH和體積均相等的氨水、![]() 溶液,所需
溶液,所需![]() 的物質的量相同
的物質的量相同
C.相同溫度下,pH相等的鹽酸、![]() 溶液中,
溶液中,![]() 相等
相等
D.氨水和鹽酸反應后的溶液,若溶液呈中性,則![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙烯的分子式為C2H4,是一種重要的化工原料和清潔能源,研究乙烯的制備和綜合利用具有重要意義。
請回答下列問題:
(1)乙烯的制備:工業上常利用反應C2H6(g)![]() C2H4(g)+H2(g) △H制備乙烯。
C2H4(g)+H2(g) △H制備乙烯。
已知:Ⅰ.C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) △H1=-1556.8kJ·mol-1;
Ⅱ.H2(g)+![]() O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
O2(g)=H2O(1) △H2=-285.5kJ·mol-1;
Ⅲ.C2H6(g)+![]() O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
O2(g)=2CO2(g)+3H2O(l) △H3=-1559.9kJ·mol-1。
則△H=___kJ·mol-1。
(2)乙烯可用于制備乙醇:C2H4(g)+H2O(g)![]() C2H5OH(g)。向某恒容密閉容器中充入a mol C2H4(g)和 a mol H2O(g),測得C2H4(g)的平衡轉化率與溫度的關系如圖所示:
C2H5OH(g)。向某恒容密閉容器中充入a mol C2H4(g)和 a mol H2O(g),測得C2H4(g)的平衡轉化率與溫度的關系如圖所示:
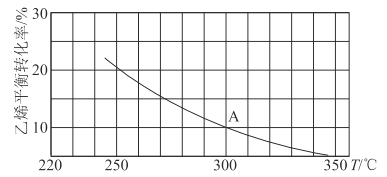
①該反應為____熱反應(填“吸”或“放”),理由為____。
②A點時容器中氣體的總物質的量為____。已知分壓=總壓×氣體物質的量分數,用氣體分壓替代濃度計算的平衡常數叫壓強平衡常數(KP),測得300℃時,反應達到平衡時該容器內的壓強為b MPa,則A點對應溫度下的KP=____MPa-1(用含b的分數表示)。
③已知:C2H4(g)+H2O(g)![]() C2H5OH(g)的反應速率表達式為v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆為速率常數,只與溫度有關。則在溫度從250℃升高到340℃的過程中,下列推斷合理的是___(填選項字母)。
C2H5OH(g)的反應速率表達式為v正=k正c(C2H4)·c(H2O),v逆=k逆c(C2H5OH),其中,k正、k逆為速率常數,只與溫度有關。則在溫度從250℃升高到340℃的過程中,下列推斷合理的是___(填選項字母)。
A.k正增大,k逆減小 B.k正減小,k逆增大
C.k正增大的倍數大于k逆 D.k正增大的倍數小于k逆
④若保持其他條件不變,將容器改為恒壓密閉容器,則300℃時,C2H4(g)的平衡轉化率__10%(填“>”“<”或“=”)。
(3)乙烯可以被氧化為乙醛(CH3CHO),電解乙醛的酸性水溶液可以制備出乙醇和乙酸,則生成乙酸的電極為_____極(填“陰”或“陽”),對應的電極反應式為___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向![]() 鹽酸中滴加
鹽酸中滴加![]() 溶液,溶液的pH隨
溶液,溶液的pH隨![]() 溶液體積的變化如圖。已知
溶液體積的變化如圖。已知![]() 。下列說法不正確的是( )
。下列說法不正確的是( )
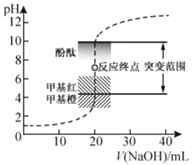
A.![]() 與鹽酸恰好完全反應時,
與鹽酸恰好完全反應時,![]()
B.選擇變色范圍在pH突變范圍內的指示劑,可減小實驗誤差
C.選擇甲基紅指示反應終點,誤差比甲基橙的大
D.![]() 時,
時,![]()
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com