
| A. | 金剛石的網狀結構中,由共價鍵形成的最小碳環上有6個碳原子 | |
| B. | 在NaCl晶體中每個Na+(或Cl-)周圍都緊鄰6個Cl-(或6個Na+) | |
| C. | 白磷晶體中,粒子之間通過共價鍵結合,鍵角為60° | |
| D. | 離子晶體在熔化時,離子鍵被破壞;而分子晶體熔化時,化學鍵不被破壞 |
分析 A.金剛石晶體中,每個碳原子形成四個共價鍵,由共價鍵形成的最小碳環上有6個碳原子;
B.氯化鈉晶體中鈉離子或氯離子的配位數都是6;
C.白磷分子為正四面體結構,原子間通過共價鍵結合,鍵角為60°;
D.離子晶體的構成微粒是陰陽離子,分子晶體的構成微粒是分子.
解答 解:A.金剛石晶體中,由共價鍵形成的最小碳環上有6個碳原子,每個碳原子形成四個共價鍵,從而形成空間網狀結構,故A正確;
B.氯化鈉晶體中鈉離子或氯離子的配位數都是6,所以在NaCl晶體中每個Na+(或C1-)周圍都緊鄰6個Cl-(或Na+),故B正確;
C.白磷分子為正四面體結構,原子間通過共價鍵結合,鍵角為60°,分子間存在范德華力,故C錯誤;
D.離子晶體的構成微粒是陰陽離子,分子晶體的構成微粒是分子,所以離子晶體在熔融狀態下能電離出陰陽離子,而分子晶體在熔融狀態下還是以分子存在,只破壞分子間作用力不破壞化學鍵,故D正確;
故選C.
點評 本題考查了晶體的有關知識,明確晶體結構是解本題關鍵,熟練掌握教材中各種晶體代表物的結構特點,靈活運用這些知識點分析解答問題,易錯選項是B,注意B選項題干中是“微粒間”而不是“原子間”,導致很多粗心同學易錯,解答時仔細審題,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | HF的電子式: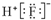 | |
| B. | 二氧化碳的結構式:O=C=O | |
| C. | Cl-離子的結構示意圖: | |
| D. | 質子數為6,中子數為8的微粒:${\;}_{6}^{8}$C |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯使溴的四氯化碳溶液褪色 | |
| B. | 將苯滴入溴水中,振蕩后水層接近無色 | |
| C. | 乙烯使酸性高錳酸鉀溶液褪色 | |
| D. | 甲烷與氯氣混合,光照一段時間后黃綠色消失 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
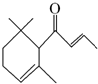 一種從植物中提取的天然化合物αdamascone可用于制作“香水”,其結構為:有關該化合物的下列說法不正確的是( )
一種從植物中提取的天然化合物αdamascone可用于制作“香水”,其結構為:有關該化合物的下列說法不正確的是( )| A. | 分子式為C13H20O | |
| B. | 該化合物可發生聚合反應 | |
| C. | 1 mol該化合物完全燃燒消耗19 mol O2 | |
| D. | 與足量溴水加成,最多消耗Br22 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
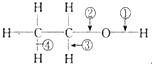 下列關于乙醇在各種不同反應中斷裂鍵的說明中,正確的是( )
下列關于乙醇在各種不同反應中斷裂鍵的說明中,正確的是( )| A. | 和金屬鈉反應,鍵③斷裂 | B. | 和金屬鈉反應,鍵②斷裂 | ||
| C. | 在Cu催化下和O2反應,鍵①、③斷裂 | D. | 在Cu催化下和O2反應,鍵②、③斷裂 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
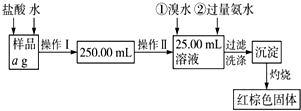 某氯化鐵樣品含有少量FeCl2雜質.現要測定其中鐵元素的質量分數,實驗按以下步驟進行:請根據流程,回答以下問題:
某氯化鐵樣品含有少量FeCl2雜質.現要測定其中鐵元素的質量分數,實驗按以下步驟進行:請根據流程,回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | Fe(SCN)3溶液中加入固體KSCN后顏色變深 | |
| B. | 棕紅色NO2加壓后顏色先變深后變淺 | |
| C. | SO2催化氧化成SO3的反應,往往需要使用催化劑 | |
| D. | H2、I2、HI平衡混合氣加壓后顏色變深 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用浸泡過高錳酸鉀溶液的硅藻土吸收水果產生的乙烯以達到保鮮的要求 | |
| B. | 世博會期間,利用可降解的“玉米塑料”替代常用的一次性飯盒,可防止產生白色污染 | |
| C. | 蛋白質、淀粉、纖維素這些生活中的常見物質都是天然高分子化合物 | |
| D. | 煤經氣化和液化兩個物理過程,可變為清潔能源 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com