
分析 (1)化合價升高值=化合價降低值=轉移電子數,根據化合價的變化來確定電子轉移數目;反應方程式中,系數之比等于物質的量之比;
(2)根據蓋斯定律結合熱化學方程式的書寫來回答,已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,則反應:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的;
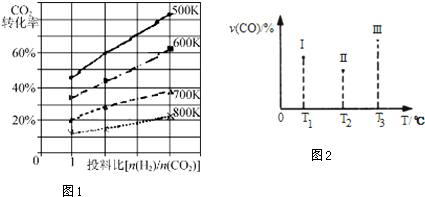
(3)平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$,圖象可知溫度升高二氧化碳轉化率減小,說明升溫平衡逆向進行;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,該反應正反應為放熱反應,根據圖4中Ⅰ、Ⅱ、Ⅲ圖象,CO百分含量,由小到大,Ⅱ<Ⅰ<Ⅲ,結合化學平衡移動分析解答;根據溫度對平衡的影響來判斷,升高溫度平衡逆向移動,CO的轉化率減小;
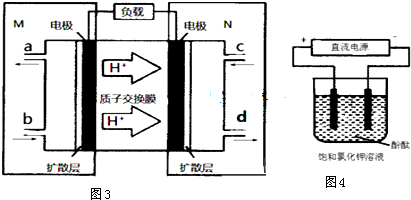
(5)①左端為負極,在酸性電解質中失去電子生成氮氣和氫離子;
②該燃料電池的能量利用率為80%,即電池轉移電子的80%=電解中轉移電子,結合電子轉移守恒計算.
解答 解:(1)NO+O3═NO2+O2,生成1mol氧氣轉移電子是2mol,生成11.2L即0.5mol O2(標準狀況)時,轉移電子的物質的量是1mol,當n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的系數之比是3:2,其方程式表示為:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案為:1,6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:A、NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
B、2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,則反應:2NO(g)+O2(g)=2NO2(g)可以看成是B-2A得到的,所以該反應的△H=-196.6kJ•mol-1-2(-41.8kJ•mol-1)=-113.0 kJ•mol-1,
故答案為:2NO(g)+O2(g)=2NO2(g)△H=-113.0 kJ•mol-1;
(3)2CO2(g)+6H2(g)$\frac{\underline{\;催化劑\;}}{\;}$CH3OCH3(g)+3H2O(g);該反應平衡常數表達式為K=$\frac{{c}^{3}({H}_{2}O)c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$,圖象可知溫度升高二氧化碳轉化率減小,說明升溫平衡逆向進行,逆向反應是吸熱反應,正反應為放熱反應,△H<0,
故答案為:$\frac{{c}^{3}({H}_{2}O)c(C{H}_{3}OC{H}_{3})}{{c}^{2}(C{O}_{2}){c}^{6}({H}_{2})}$;小于;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,該反應正反應為放熱反應,根據圖4中Ⅰ、Ⅱ、Ⅲ圖象,CO百分含量,由小到大依次為:Ⅱ<Ⅰ<Ⅲ,T1中的狀態轉變成T2中的狀態,CO百分含量減小,說明平衡正向移動,說明T1未達平衡狀態,T2中的狀態轉變成T3中的平衡狀態,CO百分含量增大,說明平衡逆向移動,說明T2可能達平衡狀態,一定達到化學平衡狀態的是Ⅲ,該反應正反應為放熱反應,升高溫度,平衡逆向移動,若三個容器內的反應都達到化學平衡時,Ⅰ容器溫度最低,所以CO轉化率最大的反應溫度是T1,
故答案為:Ⅲ;T1;
(5)①由氫離子的移動方向可知,M區為負極,發生的電極反應式為N2H4-4e-=N2↑+4H+,故答案為:N2H4-4e-=N2↑+4H+;
②用惰性電極,電解飽和KCl總的電極反應式為2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$H2↑+Cl2↑+2OH-,pH值變為13時,c(OH-)=0.1mol/L,n(OH-)=0.1mol/L×0.5L=0.05mol,
N2H4~4e-~4OH-
32g 4mol
x×80% 0.05mol,
解得x=0.5g,
故答案為:0.5.
點評 本題目綜合考查蓋斯定律的應用、化學反應平衡常數的計算和應用、電化學原理及計算等方面的知識,側重于影響平衡移動及平衡常數的因素的考查,注意知識的歸納和整理是關鍵,題目難度中等.注意(4)從圖象中曲線的變化趨勢分析條件改變導致平衡移動的特點.


科目:高中化學 來源: 題型:推斷題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 焦炭與CO、H2均是重要的能源,也是重要的化工原料.
焦炭與CO、H2均是重要的能源,也是重要的化工原料.查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 2min | 4min | 6nin | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH2OH | 0.03 | 0.04 | 0.04 | 0.05 | … |

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
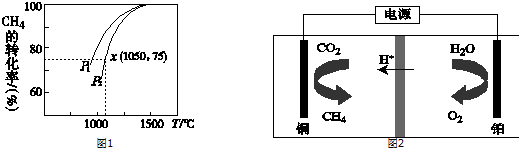
| A. | 反應①中電能轉化為化學能 | |
| B. | 反應②為放熱反應 | |
| C. | 反應③使用催化劑,△H3減小 | |
| D. | 反應②中,反應物的鍵能大于生成物的鍵能 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com