
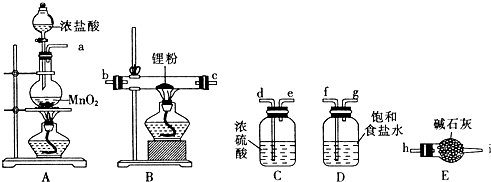
分析 根據題中提供的實驗裝置可知,用濃鹽酸與二氧化錳發生氧化還原反應,生成氯氣,所得氯氣中有氯化氫和水雜質,所以制得的氯氣先通過飽和食鹽水,除去氯化氫,再通過濃硫酸干燥,得干燥純凈的氯氣,與鋰反應生成氯化鋰,反應中未反應的氯氣會污染空氣,用堿石灰吸收尾氣,同時能防止空氣中的水蒸氣進入使氯化鋰潮解,據此答題.
解答 解:由題中提供的實驗裝置可知,用濃鹽酸與二氧化錳發生氧化還原反應,生成氯氣,所得氯氣中有氯化氫和水雜質,所以制得的氯氣先通過飽和食鹽水,除去氯化氫,再通過濃硫酸干燥,得干燥純凈的氯氣,與鋰反應生成氯化鋰,反應中未反應的氯氣會污染空氣,用堿石灰吸收尾氣,同時能防止空氣中的水蒸氣進入使氯化鋰潮解,
(1)根據上面的分析可知,A中發生反應的離子方程式為MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O,
故答案為:MnO2+4H++2Cl- $\frac{\underline{\;\;△\;\;}}{\;}$ Mn2++Cl2↑+2H2O;
(2)根據上面的分析可知,上述裝置按氣流方向的連接順序為:a→f,g→d,e→b,c或c,b→h,
故答案為:f、g;d、e;b、c或c、b;h;
(3)根據上面的分析可知,裝置D的作用是吸收HCl,裝置E的作用是防止空氣中的水蒸氣進入使氯化鋰潮解和吸收多余的Cl2,防止污染空氣,
故答案為:吸收HCl;吸收多余的Cl2,防止污染空氣;
(4)若反應前金屬鋰的質量為3.80g,設未反應的鋰為xg,根據方程式2Li+Cl2=2LiCl,有$\frac{14}{3.8-x}=\frac{42.5×2}{21.55-x}$,所以x=0.3,所以生成LiCl的質量為21.55g-0.3g=21.25g,所得產品中氯化鋰的質量分數為$\frac{21.25}{21.55}$×100%=98.6%,
故答案為:98.6%.
點評 本題考查物質的含量測定,側重于學生的分析能力、計算能力和實驗能力的考查,題目難度不大,注意把握實驗原理的分析和相關實驗基本方法及注意事項.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 所有原子不在同一平面 | |
| B. | 能使酸性高錳酸鉀溶液褪色 | |
| C. | 燃燒時有濃煙 | |
| D. | 與足量溴水反應時,生成物中只有2個碳原子上有溴原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 消去反應,加成反應,取代反應 | B. | 取代反應,消去反應,加成反應 | ||
| C. | 消去反應,取代反應,加成反應 | D. | 取代反應,加成反應,消去反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 物質 | 溶解度/(g/100g水) | ||
| 0°C | 40°C | 80°C | |
| KCl | 28 | 40.1 | 51.3 |
| NaCl | 35.7 | 36.4 | 38 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
| Na2Cr2O7 | 163 | 215 | 376 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵釘放入硫酸銅溶液中,溶液由藍色變為淺綠色 | |
| B. | 將空氣中燃著的硫伸入氧氣瓶中,火焰由黃色變為藍紫色 | |
| C. | 高溫加熱木炭與氧化銅的混合物,固體由黑色變成紅色 | |
| D. | 往水中加入少量高錳酸鉀,液體由無色變成紫紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |

 ,化學鍵有離子鍵、共價鍵
,化學鍵有離子鍵、共價鍵
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com