
【題目】下列離子方程式書寫正確的是
A. 鈉和冷水反應:Na+2H2O=Na++2OH+H2↑
B. 澄清石灰水與少量NaHCO3溶液混合:Ca2+ + OH-+ HCO3-![]() CaCO3↓+ H2O
CaCO3↓+ H2O
C. 向沸水中滴入適量的飽和氯化鐵溶液;Fe 3++3H2O![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
D. 碳酸氫銨溶液中加入過量氫氧化鈉溶液 HCO3-+ OH-=CO32-+ H2O
 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:
【題目】下列溶液中,在指定條件下能大量共存的離子組是
A. 無色透明溶液中:Na+ 、Cu2+ 、Cl- 、S2
B. 遇酚酞試劑變紅的溶液:Fe3+ 、K+ 、SO42 、NO![]()
C. 含有大量 CO32-的溶液:K+ 、 Ba2+ 、OH- 、SO42
D. 含有大量 H+ 的溶液:Mg2+ 、NH4+ 、NO3- 、Cl-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA阿伏伽德羅常數的值。己知反應
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1="a" kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2="b" kJ/mol,其它數據如表:
化學鍵 | C═O | O═O | C-H | O-H |
鍵能kJ·mol-1 | 798 | x | 413 | 463 |
下列說法正確的是
A. 上表中 x=(1796+b)/2
B. H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C. 當有4NA個C-H鍵斷裂時,該反應放出熱量一定為a kJ
D. 利用反應(1)設計的原電池電解精煉銅時,當負極輸出0.2NA個電子時,電解槽的陽極質量一定減輕6.4g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學電源的工作原理如圖。下列說法不正確的是( )

A. 采用多孔金屬作電極可增大電極接觸面積,提高對氣體的吸附能力
B. 通H2的電極作負極,發生氧化反應
C. 通O2的電極發生的電極反應:O2+4e-+4H+=2H2O
D. 該電池工作時發生的主要能量轉化形式為化學能轉化為電能和熱能
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某化學興趣小組擬用下圖裝置制備氫氧化亞鐵并觀察其顏色。提供化學藥品:鐵粉、稀硫酸、氫氧化鈉溶液。
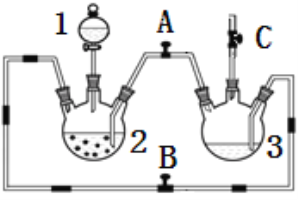
(1)稀硫酸應放在___________中(填寫儀器名稱).
(2)本實驗通過控制A、B、C三個開關,將儀器中的空氣排盡后,再關閉開關______、打開開關_______就可觀察到氫氧化亞鐵的顏色。試分析實驗開始時排盡裝置中空氣的理由_________________.
(3)該實驗使用鐵粉,除反應速率可能太快外,還可能會造成的不良后果是__________________.
(4)在FeSO4溶液中加入(NH4)2SO4固體可制備硫酸亞鐵銨晶體[(NH4)2SO4·FeSO4·6H2O] (式量為392),該晶體比一般亞鐵鹽穩定,不易被氧化,易溶于水,不溶于乙醇。
①為洗滌(NH4)2SO4·FeSO4·6H2O粗產品,下列方法中最合適的是__________。
A.用冷水洗 B.先用冷水洗,后用無水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②為了測定產品的純度,稱取a g產品溶于水,配制成500mL溶液,用濃度為c mol·L-1的酸性KMnO4溶液滴定。每次所取待測液體積均為25.00mL,實驗結果記錄如下:
實驗次數 | 第一次 | 第二次 | 第三次 |
消耗高錳酸鉀溶液體積/mL | 25.52 | 25.02 | 24.98 |
滴定過程中發生反應的離子方程式為______________________.滴定終點的現象是_____________________.通過實驗數據計算的該產品純度為______________(用字母ac表).上表中第一次實驗中記錄數據明顯大于后兩次,其原因可能是_______。
A.實驗結束時俯視刻度線讀取滴定終點時酸性高錳酸鉀溶液的體積
B.滴定前滴定管尖嘴有氣泡,滴定結束無氣泡
C.第一次滴定用的錐形瓶用待裝液潤洗過,后兩次未潤洗
D.該酸性高錳酸鉀標準液保存時間過長,有部分變質,濃度降低
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】汽車的啟動電源常用鉛蓄電池,該電池在放電時的反應如下:Pb (s)+ PbO2(s) +2H2SO4(aq)![]() 2PbSO4(s) +2H2O(l),根據此反應判斷下列敘述中正確的是
2PbSO4(s) +2H2O(l),根據此反應判斷下列敘述中正確的是
A. PbO2是電池的負極 B. 鉛蓄電池屬于一次電池
C. 負極的電極反應式為:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 電池放電時,溶液酸性增強
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向50 mL 18 mol·L-1的H2SO4溶液中加入適量的銅片并加熱。充分反應后,被還原的H2SO4的物質的量( )
A. 小于0.45 mol B. 等于0.45 mol
C. 在0.45~0.90 mol之間 D. 大于0.45 mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】固體氧化物燃料電池是以固體氧化鋯-氧化釔為電解質,這種固體電解質在高溫下允許O2-在其間通過。該電池的工作原理如下圖所示,其中多孔電極a、b均不參與電極反應。下列判斷正確的是( )

①多孔電極a為負極
②a極對應的電極反應式為O2+2H2O+4e-==4OH-
③b極的電極反應式為H2-2e-+O2-==H2O
④該電池的總反應式為2H2+O2![]() 2H2O
2H2O
A. ①② B. ②④ C. ②③ D. ③ ④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】制備乙炔的電石渣對環境污染極為嚴重,因此需要對水體進行凈化處理。現取500mL電石渣廢水(陽離子主要為Ca2+),測定水質的數據如下表所示。

注:SS表示固體懸浮物
模擬工業處理流程如下:
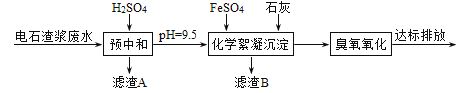
已知:i.常溫時CaSO4微溶于水; ii.溶解度: CaSO4>Fe(OH)2>FeS。
(1)①采用20%的硫酸對廢水進行預中和處理,pH變化如下圖所示。硫酸的用量和廢水中固體懸浮物(SS)含量的關系是_______。

②廢水中SS含量隨時間變化如下表所示。
靜置時間(h) | 1 | 2 | 3 | 4 | 5 | 6 | 24 |
SS含量(mg/L) | 2500 | 1800 | 1300 | 900 | 820 | 800 | 780 |
為降低成本,減少硫酸投加量的最好辦法是_______。
③濾渣A的主要成分有SS和_______。
(2)根據表中數據,回答下列問題。

①化學絮凝沉淀過程中,加入FeSO4發生反應的離子方程式是______。
②熟石灰能促進沉淀的生成,結合離子方程式,從平衡角度分析其原因是_______。
(3)用臭氧進一步處理廢水中的氰化物和殘留硫化物,若將500mL廢水中的CN-完全氧化成N2和CO2,轉移______mol e-。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com