
【題目】A、B、C、D、E、F是元素周期表前四周期中原子序數依次增大的六種常見元素,其相關信息如表:
元素 | 相 關 信 息 |
A | 原子核外有7種運動狀態不同的電子 |
B | 外圍電子排布式為nsnnpn+2 |
C | 常見的金屬,在周期表中周期序數與族序數相等 |
D | 氣態氫化物及最高價氧化物對應的水化物均為強酸 |
E | 一種核素的質量數為56,中子數為30 |
F | 單質紫紅色,電纜材料,常見氧化物為黑色 |
回答下列問題:
(1)元素E在元素周期表中的位于第四周期第族,其高價態離子核外有個未成對電子
(2)B、C、D三種元素的離子半徑由小到大的順序是(用離子符號表示).
(3)A,D兩元素的簡單氫化物發生反應生成的化合物的電子式為
(4)常溫下AD3是一種淡黃色液體.以下關于AD3的說法中,正確的是
A.AD3分子中只有非極性鍵
B.AD3分子中各原子均達8e﹣穩定結構
C.AD3的晶體屬于分子晶體
D.AD3液體氣化時化學鍵被破壞
(5)金屬C與E的黑色磁性晶體氧化物在高溫下反應,該反應的化學方程式為
(6)向F的硫酸鹽溶液中通入AH3氣體至過量,觀察到的現象是;該過程總的離子反應式為向反應后的溶液中加入適量乙醇,析出深藍色晶體,該晶體中不含有的化學鍵類型是 A.配位鍵 B.極性共價鍵 C.非極性共價鍵 D.離子鍵.
【答案】
(1)Ⅷ;5
(2)r(Al3+)<r(O2﹣)<r(Cl﹣)
(3)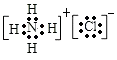
(4)BC
(5)3Fe3O4+8Al ![]() 9Fe+4Al2O3
9Fe+4Al2O3
(6)藍色溶液先產生藍色沉淀,最后沉淀溶解,形成深藍色溶液; Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4 NH3?H2O=[Cu(NH3)4]2++4H2O; C
【解析】解:(1)一種核素的質量數為56,中子數為30,質子數=質量數﹣中子數,故質子數=56﹣30=26,為鐵元素,原子序數為26,根據能量最低原理可寫出電子排布式為1S22S22P63S23P63d64s2,位于第四周期,第Ⅷ族,失去3個電子變為鐵離子,電子排布式為1S22S22P63S23P63d5,可知在3d上存在5個未成對電子,
所以答案是:Ⅷ;5;(2)B.外圍電子排布式為nSnnPn+2,s能級容納2個電子,則n=2,故外圍電子排布為2S22P4,則B為O元素;
C.元素所處的周期序數與族序數相等,則C為Al,
D.氣態氫化物及最高價氧化物對應的水化物均為強酸為氯或溴,因溴的質子數為35,而E的質子數為26,所以D為氯;
氯離子三層電子,氧離子兩層電子,鋁離子兩層電子,且核外電子排布相同,微粒半徑大小,核外電子排布,層多半徑大,所以氯離子大于鋁離子和氧離子,同核外電子排布的微粒,質子數越大,半徑越小,所以氧離子半徑大于鋁離子,所以三者的半徑大小為:r(Al3+)<r(O2﹣)<r(Cl﹣),
所以答案是:r(Al3+)<r(O2﹣)<r(Cl﹣);(3)氯化銨是離子化合物,由氨根離子與氯離子構成,電子式為: 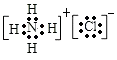 ,
,
所以答案是: 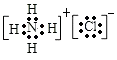 ;(4)A.NCl3分子中只存在N﹣Cl極性鍵,故A錯誤;
;(4)A.NCl3分子中只存在N﹣Cl極性鍵,故A錯誤;
B.NCl3中,N的價電子數為5,化合價為+3價,N的最外層數為5+3=8,滿足8電子穩定結構,Cl的價電子數為7,化合價為﹣1價,Cl的最外層電子數為7+|﹣1|=8,滿足8電子穩定結構,故B正確;
C.由信息可知,常溫下為液體,則NCl3晶體為分子晶體,故C正確;
D.NCl3液體氣化時分子間作用力被破壞,沒有破壞分子內的化學鍵,故D錯誤;
故選BC;(5)金屬C為鋁,E的黑色磁性晶體氧化物為四氧化三鐵,鋁粉與磁性氧化鐵(Fe3O4)混合在引燃條件下發生反應,產生高溫的同時生成氧化鋁(Al2O3)和鐵(液態,用于焊接),反應為:3Fe3O4+8Al ![]() 9Fe+4Al2O3,
9Fe+4Al2O3,
所以答案是:3Fe3O4+8Al ![]() 9Fe+4Al2O3;(6)向硫酸銅溶液中通入過量氨氣,先產生藍色氫氧化銅沉淀,離子方程式為Cu2++2NH3H2O=Cu(OH)2↓+2NH4+,繼續滴加,形成配合物四氨合銅離子使沉淀溶解,離子方程式為:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O,總離子方程式為:Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4 NH3H2O=[Cu(NH3)4]2++4H2O,現象為藍色溶液先產生藍色沉淀,最后沉淀溶解,形成深藍色溶液,[Cu(NH3)4]SO4中硫酸根離子和[Cu(NH3)4]2+存在離子鍵,N原子和銅原子之間存在配位鍵,NH3中H和N之間存在極性共價鍵,所以[Cu(NH3)4]SO4中所含的化學鍵有極性共價鍵、離子鍵、配位鍵,不含非極性共價鍵,C符合,
9Fe+4Al2O3;(6)向硫酸銅溶液中通入過量氨氣,先產生藍色氫氧化銅沉淀,離子方程式為Cu2++2NH3H2O=Cu(OH)2↓+2NH4+,繼續滴加,形成配合物四氨合銅離子使沉淀溶解,離子方程式為:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH﹣+4H2O,總離子方程式為:Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4 NH3H2O=[Cu(NH3)4]2++4H2O,現象為藍色溶液先產生藍色沉淀,最后沉淀溶解,形成深藍色溶液,[Cu(NH3)4]SO4中硫酸根離子和[Cu(NH3)4]2+存在離子鍵,N原子和銅原子之間存在配位鍵,NH3中H和N之間存在極性共價鍵,所以[Cu(NH3)4]SO4中所含的化學鍵有極性共價鍵、離子鍵、配位鍵,不含非極性共價鍵,C符合,
所以答案是:藍色溶液先產生藍色沉淀,最后沉淀溶解,形成深藍色溶液;Cu2++4NH3=[Cu(NH3)4]2+或Cu2++4 NH3H2O=[Cu(NH3)4]2++4H2O;C.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】下列實驗現象,與新制氯水中的某些成分(括號內物質)沒有關系的是( )
A.將Na2CO3固體加入新制的氯水中,有無色氣泡(H+)
B.向淀粉KI溶液中滴加新制氯水,溶液變藍(Cl2)
C.將AgNO3溶液滴加到新制氯水中,有白色沉淀產生(Cl﹣)
D.新制氯水使紅色布條褪色(HCl)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標況下,下列物質中,與0.3moLH2O含相同氫原子數的物質是( )
A.0.6mol H2SO4
B.3.612×1023個HNO3分子
C.7.3g HCl
D.4.48L CH4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,NO跟NH3可以發生反應:6NO+4NH3=5N2+6H2O,該反應中被氧化和被還原的氮元素的質量比是( )
A.3:2
B.2:1
C.1:1
D.2:3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在10L定容密閉容器中,A、B、C三種氣態物質構成了可逆反應的體系,當在某一溫度時,A,B,C物質的量與時間的關系如圖1,C的百分含量與溫度的關系如圖2.下列分析不正確的是( ) 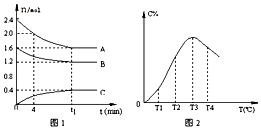
A.t1時刻前,混合氣體的密度減小,t1時刻后,混合氣體的密度不變
B.該反應的平衡常數表達式K= ![]()
C.由T1向T2變化時,V正>V逆
D.此反應的正反應為放熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
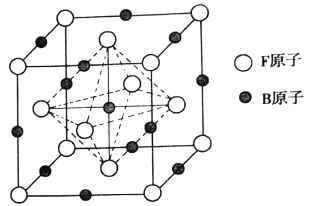
【題目】A、B、C、D、E、X、F是周期表中前四周期的七種元素,它們的原子序數依次增大。A元素的核外電子數和電子層數相等,是宇宙中最豐富的元素。B的最外層電子數為其內層電子數的2倍,D基態原子的s能級和p能級上電子數相等,E在短周期元素中第一電離能最小,X與D同主族,F在周期表的第八列。
(1)基態F原子的核外有_______種運動狀態的電子。基態F3+的最外層電子排布式是________。
(2)B、C、D三種元素的電負性由大到小的排列是_______(填元素符號)。
(3)A、B、D形成BA2D型分子,該分子的空間構型為________。
(4)BC-中B原子的雜化軌道類型是_______,該離子中含有的σ鍵與π鍵的數目之比為_____。寫出一種與該分子互為等電子體的單質分子的結構式_______。
(5)E2X與E2D相比較熔點較高的是______(填化學式),原因是__________。
(6)奧氏體是B溶解在F中形成的一種間隙固溶體,無磁性,其晶胞為面心立方結構,如圖所示,則該物質的化學式為_______。若晶體密度為dg.cm-3,則晶胞中最近的兩個B原子的距離為______pm(阿伏加德羅常數的值用NA表示,寫出簡化后的計算式即可)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H 現在體積為1L的密閉容器中,充入CO2和H2 . 實驗測得反應體系中物質的物質的量與時間關系如下表,
n(CO2) | n(H2) | n(CH3OH(g) | n(H2O(g) | |
0 | 1.00mol | 3.25mol | 0.00 | 0.00 |
5min | 0.50mol | 0.50mol | ||
10min | 0.25mol | 0.75mol | ||
15min | 0.25mol | n1 |
回答下列問題:
(1)表格中的n1=
(2)0﹣5min內 v (H2)=
(3)該條件下CO2的平衡轉化率為 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應屬于不屬于取代反應的是( )
A.油脂的水解
B.在一定條件下,苯與濃硝酸反應制取硝基苯
C.乙醛與氫氣的反應
D.甲烷與氯氣在光照條件下反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某草酸晶體的化學式可表示為H2C2O4xH2O,為測定x的值,進行下列實驗: ①稱取7.56g某草酸晶體配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于錐形瓶中,加入適量稀H2SO4 , 用濃度為0.600mol/L的KMnO4溶液滴定,滴定終點時消耗KMnO4 的體積為10.00mL.
(1)若滴定終點時仰視讀數,則所測x的值將(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com