
分析 (1)實驗有兩個過程:配制準確濃度的草酸溶液,所需要的實驗儀器主要有天平(含砝碼)、燒杯、藥匙、100mL容量瓶、膠頭滴管、玻璃棒等;
用高錳酸鉀溶液進行滴定測草酸的物質的量:所需要的實驗儀器主要有燒杯、酸式滴定管、鐵架臺(帶滴定管夾)、錐形瓶等;根據以上操作中使用的儀器進行解答;
(2)KMnO4溶液具有強氧化性,能夠腐蝕橡皮管,故KMnO4溶液應裝在酸式滴定管中;
(3)根據實驗操作對c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$的影響分析誤差;
(4)根據化學方程式中各物質的關系進行計算出草酸的濃度,從而計算出樣品中含有草酸的質量、結晶水的質量,最后計算出草酸晶體中x值.
解答 解:(1)為了準確配制一定濃度濃度的草酸溶液,所需要的實驗儀器主要為:天平(含砝碼)、燒杯、藥匙、100mL容量瓶、膠頭滴管、玻璃棒等;
用高錳酸鉀溶液進行滴定測草酸的物質的量,所需要的實驗儀器主要有:燒杯、酸式滴定管、鐵架臺(帶滴定管夾)、錐形瓶等,
則在以上操作中不需要的儀器有:c.100mL量筒、f.漏斗;還缺少的儀器為:鐵架臺(帶滴定管夾),
故答案為:cf;鐵架臺(帶滴定管夾);
(2)KMnO4溶液具有強氧化性,可以腐蝕堿式滴定管中的橡皮管,故KMnO4溶液應裝在酸式滴定管中,
故答案為:酸;KMnO4溶液有強氧化性,能腐蝕堿式滴定管中的橡皮管;
(3)在接近滴定終點時,用少量蒸餾水將錐形瓶內壁沖洗一下,再繼續滴定至終點,蒸餾水不影待測液的物質的量,對V(標準)無影響,根據c(待測)=$\frac{c(標準)×V(標準)}{V(待測)}$可知,c(待測)不變,則對所測得的x值無影響,
故答案為:無影響;
(4)2KMnO4 ~5H2C2O4
2 5
aV×10-3mol 0.025×cmol
c=$\frac{5aV×1{0}^{-3}mol}{2×0.025mol}$=0.1aVmol•L-1,
樣品中含有草酸的質量為:90g/mol×0.1aVmol/L×0.025L×4=0.9aVg,Wg草酸晶體中含有結晶水的質量為Wg-0.9aVg,
草酸晶體中含有結晶水數目為:x=$\frac{\frac{Wg-0.9aVg}{18g/mol}}{\frac{0.9aVg}{90g/mol}}$=$\frac{50W}{9aV}$-5,
故答案為:0.1aV;$\frac{50W}{9aV}$-5.
點評 本題考查一定物質的量濃度溶液配制、滴定操作中儀器的選用及滴定誤差分析,題目難度中等,注意掌握配制一定物質的量濃度的溶液即中和滴定操作的方法,能夠根據操作步驟選用儀器、根據操作方法判斷滴定誤差.


科目:高中化學 來源: 題型:選擇題
| A. | Cu2+、Na+、SO42-、Cl- | B. | K+、Na+、HCO3-、NO3- | ||
| C. | OH-、Cl-、Ca2+、Na+ | D. | Fe2+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,22.4L SO3所含的分子數目為NA | |
| B. | 0.2molH2O2催化分解,轉移電子數為0.2NA | |
| C. | 0.1mol/L的100mLH2SO3溶液中,含有的離子數約為0.03NA | |
| D. | 6.25 mL1 mol/L濃硫酸與足量銅反應,轉移電子數為0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
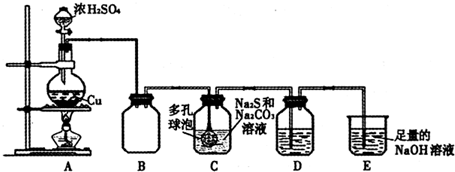
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
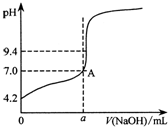 現用鄰苯二甲酸氫鉀(本題中用KHA表示)標準溶液來測定某NaOH溶液的濃度,進行如下操作:
現用鄰苯二甲酸氫鉀(本題中用KHA表示)標準溶液來測定某NaOH溶液的濃度,進行如下操作:查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
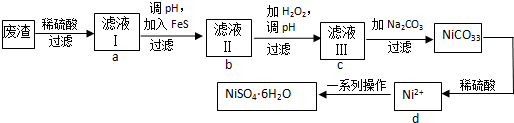
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5.4KJ | B. | 350KJ | C. | 3.5KJ | D. | 8.5KJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com