
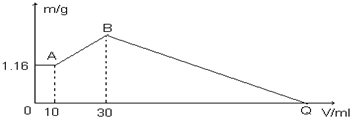
分析 向水中固體組成的混合物溶液中加入鹽酸時,0-A時沒有沉淀生成,說明溶液中NaOH過量,則鋁離子完全轉化為偏鋁酸根離子,溶液中存在的沉淀為Mg(OH)2;
A-B段,鹽酸和偏鋁酸鈉反應生成氫氧化鋁沉淀,離子反應方程式為H2O+AlO2-+H+=Al(OH)3↓,B點溶液中存在的溶質是氯化鈉,沉淀為Mg(OH)2、Al(OH)3;
B-C過程中,氫氧化鎂和氫氧化鋁都與鹽酸反應生成氯化鋁和氯化鎂,所以Q點溶液中的溶質是氯化鋁、氯化鎂和氯化鈉.
解答 解:(1)向水中固體組成的混合物溶液中加入鹽酸時,0-A時沒有沉淀生成,說明此時鹽酸和氫氧化鈉反應,即:NaOH、MgCl2、AlCl3三種固體組成的混合物溶于足量水后,溶液中NaOH過量,此時溶液中鋁離子為偏鋁酸根離子,溶液中存在的沉淀為Mg(OH)2;
故答案為:Mg(OH)2;
(2)A-B段有沉淀生成,應為鹽酸和偏鋁酸鈉反應生成氫氧化鋁沉淀,離子反應方程式為AlO2-+H++H2O=Al(OH)3↓,B點溶液中存在的溶質是氯化鈉,沉淀為Mg(OH)2、Al(OH)3,離子反應方程式為:H2O+AlO2-+H+=Al(OH)3↓,根據HCl的體積知,n(AlO2-)=n(HCl)=1mol/L×(0.03-0.01)L=0.02mol,根據Al原子守恒得n(AlCl3)=n(AlO2-)=0.02mol,m(AlCl3)=n(AlCl3)•M=0.02mol×133.5g/mol=2.67g,
故答案為:2.67g;
(3)A點沉淀的是氫氧化鎂,則n(Mg(OH)2)=$\frac{m}{M}$=$\frac{1.16g}{58g/mol}$=0.02mol,根據Mg原子守恒得n(MgCl2)=n(Mg(OH)2)=0.02mol;
B-Q過程中,氫氧化鎂和氫氧化鋁都與鹽酸反應生成氯化鋁和氯化鎂,所以Q點溶液中的溶質是氯化鋁、氯化鎂和氯化鈉,原反應物為:NaOH、MgCl2、AlCl3和鹽酸,對比知反應前后MgCl2、AlCl3不變,實際上相當于氫氧化鈉和鹽酸的反應,所以Q點可以看做氫氧化鈉和鹽酸二者恰好反應,n(NaOH)=n(HCl),B點溶液中存在的溶質是氯化鈉,由Na+離子和Cl-離子守恒得,原混合物中:n(NaOH)=n(NaCl)=n(Cl-)=2n(MgCl2)+3n(AlCl3)+n(HCl)=0.02mol×2+0.02mol×3+0.03L×1mol/L=0.13mol,
則V(HCl)=$\frac{0.13mol}{1mol/L}$=0.13L=130mL,
故答案為:130.
點評 本題考查混合物反應的有關計算,題目難度中等,明確曲線變化趨勢及每段發生的化學反應是解本題關鍵,知道拐點代表的含義及溶液中溶質的成分,結合方程式、原子守恒對有關問題進行分析從而得出正確答案,注意掌握守恒思想在化學計算中的應用,試題培養了學生的化學計算能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 等濃度時水溶液堿性:NaHCO3>Na2CO3 | |
| B. | 熱穩定性:NaHCO3>Na2CO3 | |
| C. | 與鹽酸溶液反應的速率(快慢):NaHCO3<Na2CO3 | |
| D. | 等質量的Na2CO3、NaHCO3分別與足量的鹽酸反應,NaHCO3產生的CO2多 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
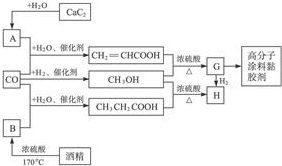
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 質子數為53、中子數為78的碘原子:${\;}_{53}^{131}$I | |
| B. | 硫離子的結構示意圖: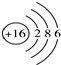 | |
| C. | H2O2的結構式:H-O-H-O | |
| D. | NH4I的電子式: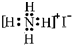 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)3 | D. | Fe3O4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeO與稀硝酸反應:FeO+2H+═Fe2++H2O | |
| B. | (NH4)2Fe(SO4)2溶液與過量NaOH溶液反應:Fe2++2OH-═Fe(OH)2↓ | |
| C. | 向碳酸鈉溶液中逐滴加入與之等體積等物質的量濃度的稀醋酸:CO32-+H+═HCO3- | |
| D. | 向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+═2Fe(OH)3+3Mg2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | “地溝油”禁止食用,但可以用來制皂 | |
| B. | 安全、合理的使用核能有利于降低碳排放 | |
| C. | 采用“靜電除塵”、“燃煤固硫”、“汽車尾氣催化凈化”等方法,可提高空氣質量 | |
| D. | 吸煙不會造成室內PM 2.5污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某溶液的pH=7,則該溶液為中性溶液 | |
| B. | 一定溫度下,向AgCl飽和溶液中加入少量NaCl固體,Ksp(AgCl)減小 | |
| C. | 常溫下,反應X(s)+Y(l)═2Z(g)不能自發,則該反應的△H>0 | |
| D. | 常溫下,0.01mol/L的NaOH溶液中由水電離的c(H+)=1.0×10-2mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com