
 (1)在一次化學晚會上,一位同學表演了一個有趣的魔術:用蘸有飽和硫酸銅溶液的玻璃棒在一潔凈的鐵片上點上數處,所點之處,點鐵成“金”.你知道其中的奧妙嗎?請用化學方程式表示其反應原理Fe+CuSO4=Cu+FeSO4 .若根據上述反應設計成原電池,請在方框中畫出原電池的裝置圖,標出正、負極和電解質溶液,并寫出正負極電極反應式.
(1)在一次化學晚會上,一位同學表演了一個有趣的魔術:用蘸有飽和硫酸銅溶液的玻璃棒在一潔凈的鐵片上點上數處,所點之處,點鐵成“金”.你知道其中的奧妙嗎?請用化學方程式表示其反應原理Fe+CuSO4=Cu+FeSO4 .若根據上述反應設計成原電池,請在方框中畫出原電池的裝置圖,標出正、負極和電解質溶液,并寫出正負極電極反應式.分析 (1)鐵和硫酸銅溶液發生置換反應;原電池的總反應為Fe+Cu2+=Fe2++Cu,根據原電池反應設計原電池,原電池正極材料為較不活潑金屬或非金屬材料,正極上發生還原反應;
(2)在高溫下,輝銅礦先與氧氣反應生成氧化亞銅和二氧化硫,氧化亞銅繼續與硫化亞銅反應生成銅和二氧化硫;
(3)發生2CuS+3O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+2SO2、Cu2S+2O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+SO2,可知CuS在反應前后固體的質量減小,而Cu2S燃燒后固體質量不變,利用其質量的變化可鑒別.
解答 解:(1)鐵和硫酸銅溶液發生置換反應,方程式為Fe+CuSO4=Cu+FeSO4 ,原電池的總反應為Fe+Cu2+=Fe2++Cu,則該原電池中,Fe為負極,負極反應Fe-2e-=Fe2+,Cu(或C)為正極,正極發生還原反應,電極反應式為Cu2++2e-=Cu,電解質溶液為硫酸銅溶液,
則原電池裝置為 ,
,
故答案為:Fe+CuSO4=Cu+FeSO4 ; ;Cu2++2e-=Cu;Fe-2e-=Fe2+;
;Cu2++2e-=Cu;Fe-2e-=Fe2+;
(2)焙燒礦石的反應應該是硫化亞銅與氧氣反應生成氧化亞銅和二氧化硫,方程式為:2Cu2S+3O2$\frac{\underline{\;高溫\;}}{\;}$2Cu2O+2SO2,隔絕空氣再進行焙燒,進行的反應應該是氧化亞銅繼續與硫化亞銅反應生成銅和二氧化硫,方程式為:2Cu2O+Cu2S$\frac{\underline{\;高溫\;}}{\;}$6Cu+SO2↑,
故答案為:2Cu2S+3O2$\frac{\underline{\;高溫\;}}{\;}$2Cu2O+2SO2、2Cu2O+Cu2S$\frac{\underline{\;高溫\;}}{\;}$6Cu+SO2↑;
(3)CuS、Cu2S均為黑色不溶于水的固體,在空氣中灼燒生成CuO與SO2,發生的燃燒反應分別為2CuS+3O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+2SO2、Cu2S+2O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+SO2,則分別稱量相同質量的CuS、Cu2S,然后在坩堝中充分燃燒,冷卻至室溫稱量剩余固體的質量,質量減小的為CuS,質量不變的為Cu2S,
故答案為:分別稱量相同質量的CuS、Cu2S,然后在坩堝中充分燃燒,冷卻至室溫稱量剩余固體的質量,質量減小的為CuS,質量不變的為Cu2S.
點評 本題考查較為綜合,涉及物質的鑒別、原電池的設計等知識,為高頻考點,把握物質的性質、發生的反應及反應前后固體質量變化為解答的關鍵,側重分析與實驗能力的綜合考查,題目難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 若X為直流電源,Y為銅棒接正極,則Fe棒上有銅析出 | |
| B. | 若X為直流電源,Y為碳棒接負極,則Fe棒被保護 | |
| C. | 若X為電流計,Y為鋅棒,則SO42-移向Fe棒 | |
| D. | 若X為導線,Y為銅棒,則Fe棒發生還原反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2種 | B. | 3種 | C. | 4 種 | D. | 5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
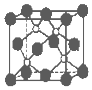 磷化硼是一種超硬耐磨涂層材料.如圖為其晶體結構中最小的重復結構單元,其中的每個原子均滿足8電子穩定結構.下列有關說法正確的是( )
磷化硼是一種超硬耐磨涂層材料.如圖為其晶體結構中最小的重復結構單元,其中的每個原子均滿足8電子穩定結構.下列有關說法正確的是( )| A. | 磷化硼晶體的化學式為BP,屬于離子晶體 | |
| B. | 磷化硼晶體的熔點高,且熔融狀態下能導電 | |
| C. | 磷化硼晶體結構微粒的空間堆積方式與氯化鈉相同 | |
| D. | 磷化硼晶體中每個原子均形成4個共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
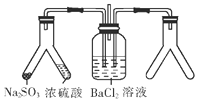
| A. | 大理石和稀鹽酸 | B. | CaO和濃氨水 | C. | Cu和濃硝酸 | D. | MnO2和雙氧水 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com