
【題目】如下圖所示,A、F為石墨電極,B、E為鐵片電極。按要求回答下列問題。

(1)打開K2,合并K1。B為________極,A的電極反應為________________________。最終可觀察到的現象是___________________________________________。
涉及的化學反應方程式有_______________________________。
(2)打開K1,合并K2。E為________極,F極的電極反應為_____,檢驗F極產生氣體的方法是____________________________。
(3)若往U形管中滴加酚酞,進行(1)(2)操作時,A、B、E、F電極周圍能變紅的是________,原因是___________________________________________。
【答案】負O2+2H2O+4e-===4OH-溶液中有紅褐色沉淀生成2Fe+O2+2H2O===2Fe(OH)2、4Fe(OH)2+O2+2H2O===4Fe(OH)3陰2Cl--2e-===Cl2↑用濕潤的淀粉碘化鉀試紙靠近F極,試紙變藍,證明是氯氣AE因為A極產生OH-,E極中H+反應了,促進了水的電離,溶液中有OH-剩余,酚酞遇OH-變紅,所以溶液變紅
【解析】
(1)打開K2,合并K1,裝置為原電池,B為負極,A為正極,所發生的反應本質上是鋼鐵的吸氧腐蝕,故答案為:負、O2+2H2O+4e-==4OH-、溶液中有紅褐色沉淀生成、2Fe+O2+2H2O===2Fe(OH)2、4Fe(OH)2+O2+2H2O===4Fe(OH)3;(2)打開K1,合并K2,裝置為電解池,由于鐵作陰極,所以該裝置就是電解食鹽水,故答案為:陰、2Cl--2e-===Cl2↑、用濕潤的淀粉碘化鉀試紙靠近F極,試紙變藍,證明是氯氣、AE、因為A極產生OH-,E極中H+反應了,促進了水的電離,溶液中有OH-剩余,酚酞遇OH-變紅,所以溶液變紅。


 黃岡小狀元解決問題天天練系列答案
黃岡小狀元解決問題天天練系列答案 三點一測快樂周計劃系列答案
三點一測快樂周計劃系列答案科目:高中化學 來源: 題型:
【題目】實驗小組用下列裝置進行乙醇催化氧化的實驗。已知:乙醛可被氧化為乙酸。
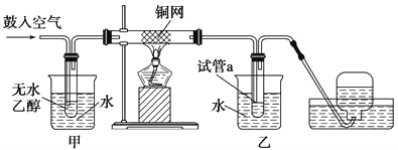
(1)實驗過程中銅網出現紅色和黑色交替的現象,請寫出相應的化學方程式__________________ 、_____________________。
(2)在不斷鼓入空氣的情況下,熄滅酒精燈,反應仍能繼續進行,說明該乙醇催化反應是____________ 反應。進一步研究表明,鼓入空氣的速率與反應體系的溫度關系曲線如圖所示。
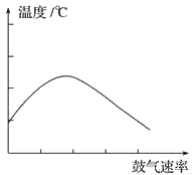
試解釋出現圖中現象的原因_______________________。
(3)甲和乙兩個水浴作用不相同。甲的作用是_______________;乙的作用是______________。
(4)若試管a中收集到的液體用紫色石蕊試紙檢驗,試紙顯紅色,說明液體中還含有_______。要除去該物質,可在混合液中加入________ (填寫字母)。然后,再通過________________(填實驗操作名稱)即可除去。
A.氯化鈉溶液 B.苯 C.碳酸氫鈉溶液 D.四氯化碳
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】第三周期第ⅡA、ⅢA族金屬元素的原子失去電子后,生成的陽離子的電子層結構( )。
A.與它同周期稀有氣體元素原子的電子層結構相同
B.與它上一周期稀有氣體元素原子的電子層結構相同
C.與它下一周期稀有氣體元素原子的電子層結構相同
D.以上說法都不全面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 根據反應Cu+H2SO4![]() CuSO4+H2↑可推出Cu的還原性比H2的強
CuSO4+H2↑可推出Cu的還原性比H2的強
B. 電解含Pb(NO3)2和Cu(NO3)2的溶液,陰極上陽離子得電子次序依次是Cu2+、H+、Pb2+
C. 含amolNa2S的溶液最多能吸收2.5amol的二氧化硫氣體(不考慮SO2在水中的溶解)
D. 由置換反應I2+2NaClO3===2NaIO3+Cl2可知I2的氧化性強于Cl2的氧化性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于如圖所示裝置的敘述錯誤的是
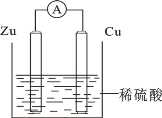
A. 鋅是負極,其質量逐漸減小
B. 氫離子在銅表面得e-
C. 電子從鋅片經導線流向銅片
D. 電流從鋅片經導線流向銅片
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式正確的是
A. 向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
B. 向氨水中加入少量H2C2O4溶液:H2C2O4 +2NH3·H2O ![]() C2O4 2—+2NH
C2O4 2—+2NH![]() +2H2O
+2H2O
C. 氫氧化鈉溶液中加入鋁粉:2Al+2OH- +6H2O === 2Al(OH)4-+3H2↑
D. 向CuSO4溶液中加入Na2O2:2Na2O2+2H2O===4Na++4OH-+O2↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:
①CO(g)+![]() O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+![]() O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
下列說法正確的是( )
A. 通常狀況下,氫氣的燃燒熱為241.8 kJ·mol-1
B. 由①可知,1 mol CO(g)和![]() mol O2(g)反應生成 1 mol CO2(g),放出283.0 kJ的熱量
mol O2(g)反應生成 1 mol CO2(g),放出283.0 kJ的熱量
C. 可用下圖表示2CO2(g)===2CO(g)+O2(g)反應過程中的能量變化關系
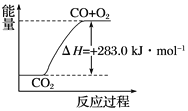
D. 分解1 mol H2O(g),其反應熱為-241.8 kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com