
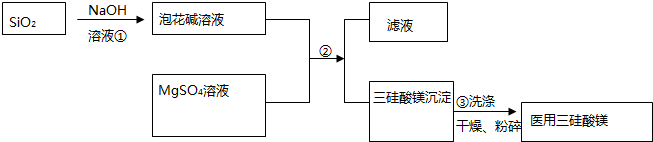
分析 (1)SiO2與NaOH反應生成Na2SiO3;將直徑為1~100nm的SiO2顆粒分散到丙酮中形成膠體;
(2)NaClO溶液將Mn2+氧化為MnO2;
(3)過濾操作裝置為 ,其中A、B、C為玻璃儀器;制備Mg2Si3O8•nH2O時,用到gSO4,沉淀混有SO42-,檢驗SO42-判斷沉淀洗滌情況;
,其中A、B、C為玻璃儀器;制備Mg2Si3O8•nH2O時,用到gSO4,沉淀混有SO42-,檢驗SO42-判斷沉淀洗滌情況;
(4)三硅酸鎂中和HCl反應的化學方程式為:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,設0.184gMgSi3O8•nH2O的物質的量是x,列式計算;
若在滴定結束時仰視讀數,V(NaOH)讀數偏大,測定剩余的鹽酸偏大,與三硅酸鎂反應的鹽酸偏小,x值偏小,n值偏高.
解答 解:(1)SiO2與NaOH反應生成Na2SiO3,則泡花堿溶液的溶質為Na2SiO3;將直徑為1~100nm的SiO2顆粒分散到丙酮中形成膠體;
故答案為:Na2SiO3;膠體;
(2)NaClO溶液將Mn2+氧化為MnO2,離子方程式為Mn2++ClO-+H2O=MnO2↓+Cl-+2H+;
故答案為:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+;
(3)過濾操作裝置為 ,其中A、B、C為玻璃儀器;制備Mg2Si3O8•nH2O時,用到gSO4,沉淀混有SO42-,步驟③中,取洗滌液少許于試管中,加入幾滴BaCl2溶液,若不產生白色沉淀,則沉淀已洗滌干凈;
,其中A、B、C為玻璃儀器;制備Mg2Si3O8•nH2O時,用到gSO4,沉淀混有SO42-,步驟③中,取洗滌液少許于試管中,加入幾滴BaCl2溶液,若不產生白色沉淀,則沉淀已洗滌干凈;
故答案為: ;取洗滌液少許于試管中,加入幾滴BaCl2溶液,若不產生白色沉淀,則沉淀已洗滌干凈;
;取洗滌液少許于試管中,加入幾滴BaCl2溶液,若不產生白色沉淀,則沉淀已洗滌干凈;
(4)三硅酸鎂中和HCl反應的化學方程式為:MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O,
根據化學方程式,設0.184gMgSi3O8•nH2O的物質的量是x,得
MgSi3O8•nH2O+4HCl═2MgCl2+3SiO2+(n+2)H2O
1 4
x 0.050L×0.1mol/L-0.030L×0.1mol/L,
解得x=0.0005mol,所以MgSi3O8•nH2O的摩爾質量是$\frac{0.184g}{0.0005mol}$=368g/mol,Mg2Si3O8的摩爾質量為260g/mol,所以18n=108,即n=6;
若在滴定結束時仰視讀數,V(NaOH)讀數偏大,測定剩余的鹽酸偏大,與三硅酸鎂反應的鹽酸偏小,x值偏小,n值偏高;
故答案為:6;偏高.
點評 本題考查制備Mg2Si3O8•nH2O,要求學生具有分析和解決問題的能力,難度大.


 課時訓練江蘇人民出版社系列答案
課時訓練江蘇人民出版社系列答案 黃岡經典趣味課堂系列答案
黃岡經典趣味課堂系列答案 啟東小題作業本系列答案
啟東小題作業本系列答案科目:高中化學 來源: 題型:多選題
| A. | 反應過程中,若降低壓強能提高SiCl4的轉化率 | |
| B. | 若反應開始時SiCl4為1 mol,則平衡時,吸收熱量為QkJ | |
| C. | 將反應的溫度由T1升高至T2,則反應的平衡常數K1>K2 | |
| D. | 當反應吸收熱量為0.25QkJ時,生成的HCl恰好能與1 molNaOH反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 金屬陽離子 | Fe3+ | Al3+ | Fe2+ | Co2+ |
| 開始沉淀的pH | 2.2 | 4.1 | 7.5 | 7.6 |
| 沉淀完全的pH | 3.5 | 5.4 | 9.5 | 9.2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
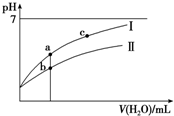 已知:25°C時某些弱酸的電離平衡常數(如表).下面圖象表示常溫下,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是( )
已知:25°C時某些弱酸的電離平衡常數(如表).下面圖象表示常溫下,稀釋CH3COOH、HClO兩種酸的稀溶液時,溶液pH隨加水量的變化.下列說法正確的是( )| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
| A. | 相同濃度CH3COONa和NaClO的混合液中,各離子濃度的大小關系是c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 向NaClO溶液中通入少量二氧化碳的離子方程式為:2ClO-+CO2+H2O═2HClO+CO32- | |
| C. | 圖象中a、c兩點處的溶液中$\frac{c({R}^{-})}{c(O{H}^{-})•c(HR)}$相等(HR代表CH3COOH或HClO) | |
| D. | 圖象中a點酸的總濃度大于b點酸的總濃度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 項目 | 結論 |
| A | 三種有機化合物:丙烯、氯乙烯、苯 | 分子內所有原子均在同一平面 |
| B | 由溴丙烷水解制丙醇、由丙烯與水反應制丙醇 | 屬于同一反應類型 |
| C | 乙烯和苯都能使溴水褪色 | 褪色的原理相同 |
| D | C4H9Cl的同分異構體數目(不考慮立體異構) | 共有4種 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{8}^{18}$O2-離子結構示意圖: | B. | NH4Cl的電子式: | ||
| C. | 含78個中子的碘的核素:53131I | D. | 二氧化硅的分子式:SiO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 服用阿司匹林過量出現水楊酸(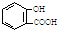 )中毒反應,可靜脈注射NaHCO3溶液: )中毒反應,可靜脈注射NaHCO3溶液: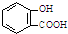 +2HCO3-→ +2HCO3-→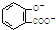 +2 CO2↑+2 H2O +2 CO2↑+2 H2O | |
| B. | 甲醛溶液與足量的銀氨溶液共熱:HCHO+4[Ag(NH3)2]++4OH-$\stackrel{△}{→}$CO32-+2NH4++4Ag↓+6NH3+2H2O | |
| C. | 向CH2BrCOOH中加入足量的氫氧化鈉溶液并加熱:CH2BrCOOH+OH-$\stackrel{△}{→}$CH2BrCOO-+H2O | |
| D. | 苯酚鈉溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ZnSO4 | B. | NaHCO3 | C. | NaHSO4 | D. | Fe(NO3)2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com