
���� ��1������������ˮ�������������һ��������
��2��NO��CO߀ԭ�������ɵ���Ͷ�����̼��
��3��NO��NO2�Ļ�Ϛ��w3L����ͬ��ͬ����3.5LNH3ʹ��ǡ����ȫ�D(zhu��n)����N2���w�e�ȵ������|(zh��)�����ȣ����O��Ϛ��w3mol��NO��NO2�քe��xmol��ymol���c���ⷴ���r��ѭ����غ㣬�Դˁ����
��4����NO2+NO+2NaOH�T2NaNO2+H2O��2NO2+2NaOH�TNaNO2+NaNO3+H2O��֪���˜ʠ�r��aL NO2��bL NO������500mLNaOH��Һ��ǡ��������ȫ���tn��N��=n��NaOH�����Y(ji��)��c=$\frac{n}{V}$Ӌ�㣻
��5���ٶ���3molNO2��ͨ�^�̼����c��Һ�����Ȱl(f��)��3NO2+H2O=2HNO3+NO������1molNO��2molHNO3���ٰl(f��)��������HNO3+NaHCO3=NaNO3+CO2��+H2O������2molCO2�����̼����c��Һ�����Ě��w��1molNO��2molCO2��ˮ���⣬��ͨ�^�������������Ě��w��1molNO��2molCO2�����wͨ�^�^�����c���l(f��)������2CO2+2Na2O2�T2Na2CO3+O2��2NO+O2=2NO2�����^�����c�����Ě��w��K��0.5molO2��1molNO2���������ˮ���ռ����l(f��)������4NO2+O2+2H2O=4HNO3����(j��)��Ӌ����
��� �⣺��1������������ˮ�������������һ����������������ʽ�飺3NO2+H2O=2HNO3+NO���ʴ𰸞飺3NO2+H2O=2HNO3+NO��
��2�����}���֪��NO��CO߀ԭ�������ɵ���Ͷ�����̼�������ķ���ʽ��2NO+2CO$\frac{\underline{\;����\;}}{\;}$N2+2CO2��
�ʴ𰸞飺2NO+2CO$\frac{\underline{\;����\;}}{\;}$N2+2CO2��
��3��NO��NO2�Ļ�Ϛ��w3L����ͬ��ͬ����3.5LNH3ʹ��ǡ����ȫ�D(zhu��n)����N2���w�e�ȵ������|(zh��)�����ȣ����O��Ϛ��w3mol������3.5mol��NO��NO2�քe��xmol��ymol��
$\left\{\begin{array}{l}{x+y=3\\;}\\{2x+4y=3.5��3}\end{array}\right.$�����x=0.75mol��y=2.25mol��
�t��Ϛ��w��NO2��NO�����|(zh��)����֮�Ȟ�2.25mol��0.75mol=3��1���ʴ𰸞飺3��1��
��4����NO2+NO+2NaOH�T2NaNO2+H2O��2NO2+2NaOH�TNaNO2+NaNO3+H2O��֪���˜ʠ�r��aL NO2��bL NO������500mLNaOH��Һ��ǡ��������ȫ���tn��N��=n��NaOH�����Y(ji��)��c=$\frac{n}{V}$=$\frac{\frac{a+b}{22.4}}{0.5}$=$\frac{a+b}{11.2}$���ʴ𰸞飺$\frac{a+b}{11.2}$��
��5���ٶ���3molNO2��ͨ�^�̼����c��Һ�����Ȱl(f��)��3NO2+H2O=2HNO3+NO������1molNO��2molHNO3���ٰl(f��)��������HNO3+NaHCO3=NaNO3+CO2��+H2O������2molCO2�����̼����c��Һ�����Ě��w��1molNO��2molCO2��ˮ���⣬��ͨ�^�������������Ě��w��1molNO��2molCO2�����wͨ�^�^�����c���l(f��)������2CO2+2Na2O2�T2Na2CO3+O2������1molO2���ٰl(f��)������2NO+O2=2NO2��1molNO����0.5molO2������1molNO2���ʏ��^�����c�����Ě��w��K��0.5molO2��1molNO2���������ˮ���ռ����l(f��)������4NO2+O2+2H2O=4HNO3��1molNO2����O2��1mol��$\frac{1}{4}$=0.25mol������Kʣ��������0.5mol-0.25mol=0.25mol���w�e֮�ȵ������|(zh��)����֮�ȣ�����K�ռ����Ě��w��0.25�w�e��O2������9mLNO2�r����ƿ�еĚ��w�w�e��0.25��$\frac{9}{3}$=0.75���ʴ𰸞飺0.75��
�c�u ���}��������߀ԭ������Ӌ�㣬����l���c����������غ������P�I����(c��)�ط����cӋ�������Ŀ��飬�}Ŀ�y�Ȳ���


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� С�W��10��犑����}ϵ�д�
С�W��10��犑����}ϵ�д�
| �꼉 | �����n�� | �꼉 | �����n�� |
| ��һ | ��һ���M�n�����]�� | ��һ | ��һ���M�n�����]�� |
| �߶� | �߶����M�n�����]�� | ���� | �������M�n�����]�� |
| ���� | �������M�n�����]�� | ���� | �������M�n�����]�� |
��Ŀ�����л��W ��Դ�� �}�ͣ�����}
 ����һ�N�ί����K����ˎ����ɼ���ϩ����ϩ��
����һ�N�ί����K����ˎ����ɼ���ϩ����ϩ�� 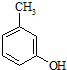 ��ԭ����ȡ��
��ԭ����ȡ��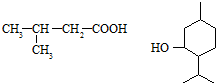 ��
�� �����Q3-�����ӣ�����ڷ����廯�����ͬ�֮���(g��u)��4�N������
�����Q3-�����ӣ�����ڷ����廯�����ͬ�֮���(g��u)��4�N������ ����
���� +CH3-CH=CH2$\stackrel{AlCl_{3}}{��}$
+CH3-CH=CH2$\stackrel{AlCl_{3}}{��}$ ������͌��ڼӳɷ������ЙC������ͨ���������^�࣬���H���a(ch��n)�аl(f��)�F(xi��n)����
������͌��ڼӳɷ������ЙC������ͨ���������^�࣬���H���a(ch��n)�аl(f��)�F(xi��n)���� 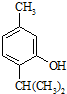 �����h��������
�����h��������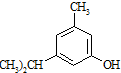 ������ԇ������ԭ���u��ʹ�ñ��h(hu��n)������λ��ԭ������ȡ����
������ԇ������ԭ���u��ʹ�ñ��h(hu��n)������λ��ԭ������ȡ����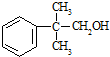 �ĺϳɾ�·�����ϳ�·�����õı�ʾ��ʽ�飺A$��_{�����l��}^{����ԇ��}$B��$��_{�����l��}^{����ԇ��}$Ŀ�ˮa(ch��n)�� ��
�ĺϳɾ�·�����ϳ�·�����õı�ʾ��ʽ�飺A$��_{�����l��}^{����ԇ��}$B��$��_{�����l��}^{����ԇ��}$Ŀ�ˮa(ch��n)�� �� ��
���鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ��x���}
| A�� | 1 | B�� | 2 | C�� | 3 | D�� | 4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ��x���}
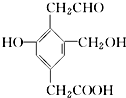 ij�ЙC��X�ĽY(ji��)��(g��u)��ʽ��D��ʾ����1mol X�քe�cH2��Na��NaOH��NaHCO3ǡ����ȫ�������t����H2��Na��NaOH��NaHCO3�����|(zh��)����֮�Ȟ飨������
ij�ЙC��X�ĽY(ji��)��(g��u)��ʽ��D��ʾ����1mol X�քe�cH2��Na��NaOH��NaHCO3ǡ����ȫ�������t����H2��Na��NaOH��NaHCO3�����|(zh��)����֮�Ȟ飨������| A�� | 4��3��2��1 | B�� | 3��3��2��1 | C�� | 4��3��2��2 | D�� | 3��3��2��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ�����}
 �像S�����������價�ˇ�������ŷŵďUˮ�к��еĄ���CN-�x�ӣ�����u���o���價�ˇ�����̎�������僵ďUˮ�r�����ڴ���TiO2�����£�����NaClO��CN-�x��������CNO-���������ԗl�����^�m(x��)��NaClO������N2��CO2���h(hu��n)�������ˆT�����]ϵ�y(t��ng)�����D�b���M�Ќ����C��̎����������Ч�ԣ����y��CN-��̎���İٷ��ʣ�����s��CN-�x�ӵ���ˮ�c�^��NaClO��Һ�Ļ��Һ��200mL������CN-�ĝ�Ȟ�0.05mol•L-1��������У�������Ƥ����һ�Εr�g���_��Ƥ���ͻ�����ʹ��Һȫ���������У��P�]������
�像S�����������價�ˇ�������ŷŵďUˮ�к��еĄ���CN-�x�ӣ�����u���o���價�ˇ�����̎�������僵ďUˮ�r�����ڴ���TiO2�����£�����NaClO��CN-�x��������CNO-���������ԗl�����^�m(x��)��NaClO������N2��CO2���h(hu��n)�������ˆT�����]ϵ�y(t��ng)�����D�b���M�Ќ����C��̎����������Ч�ԣ����y��CN-��̎���İٷ��ʣ�����s��CN-�x�ӵ���ˮ�c�^��NaClO��Һ�Ļ��Һ��200mL������CN-�ĝ�Ȟ�0.05mol•L-1��������У�������Ƥ����һ�Εr�g���_��Ƥ���ͻ�����ʹ��Һȫ���������У��P�]�������鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ��x���}
| A�� | ���P� | B�� | �����X� | C�� | ���~ | D�� | Ӳ�X |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ��x���}
| A�� | �}����xƽ�ⱻ�Ɖ� | B�� | ˮ����x�̶�һ�������� | ||
| C�� | ��Һ��pHһ�������� | D�� | c��H+���cc��OH-���ij˷eһ�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ�����}
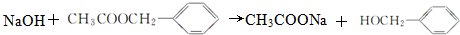 ��
�� ��
��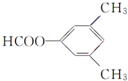 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л��W ��Դ�� �}�ͣ��x���}
| A�� | Ư�ۺ����\���������ԁ�ˮ��̎�������ߵ�����ԭ������ͬ�� | |
| B�� | Na�Ľ����Ա�Cu�����ʿ���Na�cCuSO4��Һ������ȡCu | |
| C�� | �����Î��������IJ���ƿʢ�ʼnAҺ | |
| D�� | ������ˮ�ࡢ�մɡ�ˮ��������Ҫ�Ĺ����}���� |
�鿴�𰸺ͽ���>>
����ʡ��(li��n)�W(w��ng)�`���Ͳ�����Ϣ�e��ƽ�_ | �W(w��ng)���к���Ϣ�e�^(q��) | ����p�_�e�^(q��) | ��vʷ̓�o���x�к���Ϣ�e�^(q��) | �����֙�(qu��n)�e�^(q��)
�`���Ͳ�����Ϣ�e���Ԓ��027-86699610 �e���]�䣺58377363@163.com