
【題目】2Zn(OH)2ZnCO3是制備活性ZnO的中間體,以鋅焙砂(主要成分為ZnO,含少量Cu2+、Mn2+等離子)為原料制備2Zn(OH)2ZnCO3的工藝流程如下:
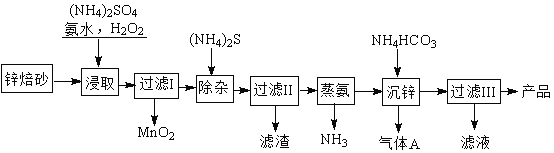
請回答下列問題:
(1)當(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42 - )時,溶液呈 (填“酸”、“堿”或“中”)性。
(2)“浸取”時為了提高鋅的浸出率,可采取的措施是 (任寫一種)。
(3)“浸取”時加入的NH3·H2O過量,生成MnO2的離子方程式為 。
(4)適量S2-能將Cu2+等離子轉化為硫化物沉淀而除去,若選擇ZnS進行除雜,是否可行?用計算說明原因: 。
[已知:Ksp(ZnS)=1.6×10-24,Ksp(CuS)=1.3×10-36]
(5)“沉鋅”的離子方程式為 。
(6)“過濾3”所得濾液可循環使用,其主要成分的化學式是 。
【答案】(1)中;(2)攪拌、適當加熱(3)Mn2++H2O2+2NH3·H2O=MnO2↓+2NH4++2H2O
(4)可行;ZnS+Cu2+=CuS+Zn2+;K=![]() =1.2×1012>>1×105
=1.2×1012>>1×105
(5)3Zn2++6HCO3—=2Zn(OH)2ZnCO3↓+5CO2↑+H2O(6)(NH4)2SO4
【解析】
試題分析:(1)根據電荷守恒可知c(H+)+c(NH4+)= c(OH-)+2c(SO42-),溶液中c(NH4+)=2c(SO42-),所以c(H+)= c(OH-),因此溶液顯中性。
(2)“浸取”時為了提高鋅的浸出率,可采取的措施有攪拌、適當加熱。
(3)“浸取”時加入的NH3·H2O過量,在堿性溶液中雙氧水氧化錳離子生成MnO2的離子方程式為Mn2++H2O2+2NH3·H2O=MnO2↓+2NH4++2H2O。
(4)根據方程式ZnS+Cu2=CuS+Zn2+可知該反應的平衡常數K=![]() =
=![]() =1.2×1012>>1×105,因此是可行的。
=1.2×1012>>1×105,因此是可行的。
(5)根據原子守恒可知“沉鋅”時生成的A氣體是二氧化碳,則反應的離子方程式為3Zn2++6HCO3 -=2Zn(OH)2ZnCO3↓+5CO2↑+H2O。
(6)“過濾3”所得濾液中含有硫酸銨,可循環使用,硫酸銨的化學式為(NH4)2SO4。


科目:高中化學 來源: 題型:
【題目】下列化學反應屬于吸熱反應的是
A. 濃H2SO4溶于水 B. 生石灰溶于水
C. 鎂與稀鹽酸反應 D. NH4Cl固體與Ba(OH)2·8H2O混合
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)將一定量的鐵粉加入到裝有200 mL某濃度的稀硝酸溶液的容器中充分反應。
①容器中剩余m1 g鐵粉,收集到NO標準狀況下體積為672 mL。
所得溶液中溶質的化學式 ,原硝酸溶液的物質的量濃度 mol/L。
②向上述固、液混合物中逐滴加入稀硫酸,直到不再產生NO氣體為止,此時容器中還剩余鐵粉m2 g
則此時溶液中溶質的化學式 ,m1-m2 的值為 g(精確到0.1g )
(2)鋁電池性能優越,Al-空氣燃料電池通常以NaCl溶液或KOH溶液為電解質溶液,通入空氣的電極為正極,以多孔石墨為正極材料。若以NaCl溶液為電解質溶液,正極的反應式為______________;若以KOH溶液為電解質溶液,電池總反應為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,10 mL 0.4 mol/LH2O2溶液發生催化分解。不同時刻測得生成O2的體積(已折算為標準狀況)如下表:
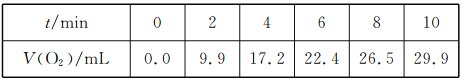
下列敘述錯誤的是(溶液體積變化忽略不計)( )
A.反應至6 min時,c(H2O2)=0.20mol/L
B.反應至6 min時,H2O2分解了40%
C.0~6 min的平均反應速率:v(H2O2)≈3.3×10-2 mol.L-1.min-l
D.6~10 min的平均反應速率:可(H2O2) <3.3×10-2 mol.L-1.min-l
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】利用反應Zn+2FeCl3===ZnCl2+2FeCl2設計一個原電池。
(1)在下圖方格內畫出實驗裝置圖,
(2)指出正極材料為__________,電極反應式為______________________;
負極材料為____________,電極反應類型為_________________________。
(3)外電路中的電子是從____________極流向__________極。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】0.5體積某氣態烴只能與0.5體積氯氣發生加成反應,生成氯代烷,0.5 mol此氯代烷可與3 mol氯氣發生完全的取代反應,則該烴的結構簡式為( )
A.CH2=CH2 B.CH3CH=CH2 C.CH3CH3 D.CH3CH2CH=CH2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】生態農業涉及農家肥料的綜合利用。某種肥料經發酵得到一種含有甲烷、二氧化碳、氮氣的混合氣體8.96L(標準狀況)。該氣體通過盛有紅色CuO粉末的硬質玻璃管,發生的反應為:CH4+4CuO ![]() CO2↑+2H2O↑+4Cu。當甲烷完全反應后,硬質玻璃管的質量減輕了4.8g。將反應后氣體通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
CO2↑+2H2O↑+4Cu。當甲烷完全反應后,硬質玻璃管的質量減輕了4.8g。將反應后氣體通入2L 0.1mol/L的澄清Ca(OH)2溶液,充分吸收,生成沉淀10g。
(1)原混合氣體的物質的量是 ;生成沉淀的摩爾質量是 。
(2)原混合氣體中甲烷的體積是 。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2.0mol PCl3和1.0mol Cl2充入體積不變的密閉容器中,在一定條件下發生下述反應:PCl3+Cl2![]() PCl5.達平衡時,PCl5為0.40mol,如果此時移走1.0mol PCl3和0.50mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
PCl5.達平衡時,PCl5為0.40mol,如果此時移走1.0mol PCl3和0.50mol Cl2,在相同溫度下再達平衡時PCl5的物質的量是( )
A. 0.40mol B. 0.20mol
C. 小于0.20mol D. 大于0.20mol,小于0.40mol
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com