
| 金屬離子 | Fe3+ | Fe2+ | Cu2+ |
| 氫氧化物開始沉淀時的pH | 1.9 | 7.0 | 4.7 |
| 氫氧化物完全沉淀時的pH | 3.2 | 9.0 | 6.7 |



 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:不詳 題型:單選題

| A.都有一定的方向性,按某一物理量標度由高到低自發進行 |
| B.都可以用來作功,自發過程一旦發生后體系作功的本領就會降低 |
| C.有一定進行限度,自發過程總是單向地趨向于非平衡狀態 |
| D.有一定的數據差來自發變化能否發生 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.0molS02 | B.2molS03 | C.1mol02 | D.1molSO3 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
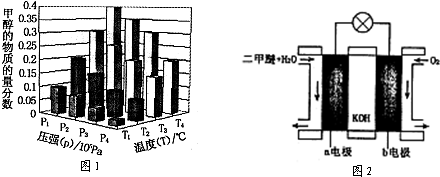
| 催化劑 |
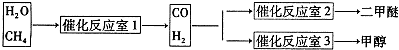
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
 HCO3-+H+的平衡常數K1=______.(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常數K1=______.(已知:10-5.60=2.5×10-6)查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 1 |
| 2 |
| 1 |
| 2 |
| A.△H2-△H1 | B.△H2+△H1 | C.△H1-△H2 | D.-△H1-△H2 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
| 催化劑 |
| 180℃ |
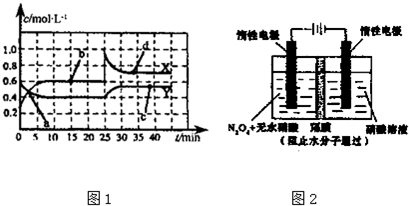
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
| A.100mL蒸餾水中; | B.100mL 0.2 mol·L-1AgNO3溶液中; |
| C.100 mL 0.1 mol·L-1AlCl3溶液中; | D.100mL 0.1 mol·L-1鹽酸溶液中。 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
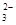 )+c(HCO
)+c(HCO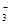 )]
)]| A.①④ | B.②③ | C.①③ | D.②④ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com