
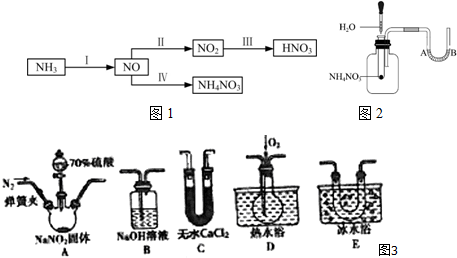
分析 (1)A中產生的氣體中含有NO、NO2、水蒸氣,所以先通過C吸收水蒸氣,然后在E中冷卻二氧化氮得到NO2,在D裝置中檢驗NO的存在,NO、NO2都是大氣污染物,所以最后在裝置B中進行尾氣處理,防止污染空氣;
(2)NO很容易被氧氣氧化,裝置中有空氣,無法檢驗有NO生成,所以通氮氣的目的是排盡整個裝置中的空氣;
(3)①盛裝70%濃硫酸的儀器名稱是分液漏斗;
②實驗確認有NO的現象是D中剛開始為無色,通入O2后變為紅棕色;
(4)通過上述實驗探究過程,可得出裝置A中反應產生 NO、NO2、水和硫酸鈉,以此書寫化學方程式;
(5)將水滴入盛有硝酸銨的試管中,觀察到的A處液面上升,B處液面下降,產生該現象與NH4NO3溶于水時吸收熱量有關;
(6)實驗室可以用氯化銨和熟石灰反應來制備氨氣,該反應的化學方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,而硝酸銨具有強的氧化性,而且分解分解產生大量氣體而發生爆炸;
(7)在汽車發生碰撞時,NaN3會產生N2氣體充滿安全氣囊;
(8)根據電子守恒、電荷守恒和原子守恒,可知離子反應IV NO發生歧化反應產生NH4+和NO3-,同時產生水,以此書寫反應的方程式.
解答 解:(1)A中產生的氣體中含有NO、NO2、水蒸氣,所以先通過C吸收水蒸氣,然后在E中冷卻二氧化氮得到NO2,在D裝置中檢驗NO的存在,NO、NO2都是大氣污染物,所以最后在裝置B中進行尾氣處理,防止污染空氣,故裝置的連接為A→C→E→D→B,
故答案為:A→C→E→D→B;
(2)NO很容易被氧氣氧化,裝置中有空氣,無法檢驗有NO生成,所以通氮氣的目的是排盡整個裝置中的空氣,防止產生的NO被氧化生成NO2,
故答案為:防止裝置中的空氣將NO氧化成NO2,影響產物的檢驗;
(3)①盛裝70%濃硫酸的儀器名稱是分液漏斗,故答案為:分液漏斗;
②實驗確認有NO的現象是D中剛開始為無色,通入O2后變為紅棕色,故答案為:D中剛開始為無色,通入O2后變為紅棕色;
(4)通過上述實驗探究過程,可得出裝置A中反應產生 NO、NO2、水和硫酸鈉,該裝置中的化學方程式是2NaNO2+H2SO4(濃)=Na2SO4+NO↑+NO2↑+H2O,
故答案為:2NaNO2+H2SO4(濃)=Na2SO4+NO↑+NO2↑+H2O;
(5)將水滴入盛有硝酸銨的試管中,觀察到的A處液面上升,B處液面下降,產生該現象的原因是NH4NO3溶于水時吸收熱量,使廣口瓶中的氣體壓強減小,在大氣壓強的作用下U形管中的液體左側A液面上升,右側B液面下降,故答案為:NH4NO3溶于水時吸收熱量;
(6)實驗室可以用氯化銨和熟石灰反應來制備氨氣,該反應的化學方程式是2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;由于硝酸銨具有強的氧化性,而且分解分解產生大量氣體而發生爆炸,所以不能代替NH4Cl來實驗,
故答案為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;不能;
(7)在汽車發生碰撞時,NaN3會產生N2氣體充滿安全氣囊來減輕碰撞事故中乘員傷害程度,故答案為:N2;
(8)根據電子守恒、電荷守恒和原子守恒,可知離子反應IV NO發生歧化反應產生NH4+和NO3-,同時產生水,反應的方程式是:8NO+7H2O=3NH4++5NO3-+2H+,
故答案為:8;7;3NH4+;5NO3-;2.
點評 本題考查物質的性質實驗及制備實驗,為高頻考點,把握化學實驗基本操作、反應現象的描述、氣體的制取方法、離子方程式的書寫及配平等知識為解答的關鍵,側重分析與實驗能力的綜合考查,題目難度中等.


 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:選擇題
| A. | 鎂元素在元素周期表中位于第三周期、第ⅡB族 | |
| B. | 第②步洗滌完畢后向洗滌液中滴加碳酸鈉溶液可檢驗沉淀是否洗滌干凈 | |
| C. | 在工業生產上可用NaOH溶液代替石灰乳 | |
| D. | 步驟⑤也可以采用電解該晶體水溶液的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
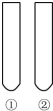 下列“試劑”和“試管中的物質”不能完成“實驗目的”的是( )
下列“試劑”和“試管中的物質”不能完成“實驗目的”的是( )| 實驗目的 | 試劑 | 試管中的物質 | |
| A | 羥基對苯環的活性有影響 | 飽和溴水 | ①苯②苯酚溶液 |
| B | 甲基對苯環的活性有影響 | 酸性KMnO4溶液 | ①苯②甲苯 |
| C | 苯分子中沒有碳碳雙鍵 | Br2的CCl2溶液 | ①苯②乙烯 |
| D | 碳酸的酸性比苯酚強 | 石蕊溶液 | ①苯酚溶液②碳酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
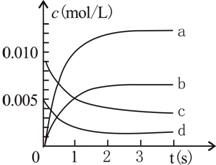 800℃時,在2L密閉容器內加入N0和02,發生反應:2N0(g)+O2(g)?2N02(g),測得n(N0)隨時間的變化如表,請回答:
800℃時,在2L密閉容器內加入N0和02,發生反應:2N0(g)+O2(g)?2N02(g),測得n(N0)隨時間的變化如表,請回答:| 時間(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向飽和FeCl3溶液中滴加過量氨水,可制取Fe(OH)3膠體 | |
| B. | 取少量溶液X,向其中加入適量新制氯水,再加幾滴KSCN溶液,溶液變紅,說明X溶液中一定含有Fe2+ | |
| C. | 向某無色溶液中加入稀鹽酸無現象,再加入BaCl2溶液產生白色沉淀,證明含SO42ˉ | |
| D. | 已知I3-?I2+I-,向盛有KI3溶液的試管中加入適量CCl4,振蕩靜置后CCl4層顯紫色,說明KI3在CCl4中的溶解度比在水中的大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水可制取金屬鈉 | |
| B. | 鈉與氧氣反應的產物與反應條件有關 | |
| C. | 氧化鈉與水反應生成氫氧化鈉 | |
| D. | 鈉可以從四氯化鈦中置換出鈦 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
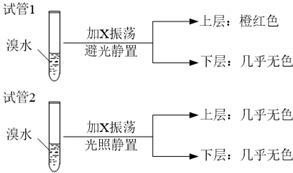
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
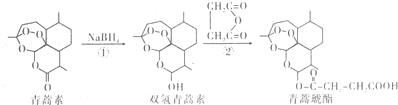
| A. | 青蒿素分子中所有碳原子在同一平面內 | |
| B. | 反應①屬于還原反應,反應②理論上原子利用率可達100% | |
| C. | 雙氫青蒿素屬于芳香化合物 | |
| D. | 青蒿琥酯可以發生水解、酯化以及加聚反應 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com