
| A. | 正極反應式為:O2+2H2O+4e-═4OH- | |
| B. | 工作一段時間后,電解液中KOH的物質的量濃度不變 | |
| C. | 該燃料電池的總反應方程式為O2+2H2═2H2O | |
| D. | 用該燃料電池CuCl2溶液,產生2.24LCl2(標況)時,有0.2mol電子轉移 |
分析 氫氧燃料堿性電池中,通入氫氣的一極為電池的負極,發生氧化反應,電極反應式為H2-2e-+2OH-=2H2O,通入氧氣的一極為電池的正極,發生還原反應,電極反應式為O2+2H2O+4e-=4OH-,反應的總方程式為2H2+O2=2H2O,結合氯氣和轉移電子之間的關系式計算.
解答 解:A.正極上氧氣得電子發生還原反應,電極反應式為O2+2H2O+4e-=4OH-,故A正確;
B.負極上氫氣和氫氧根離子反應生成水,正極上氧氣得電子和水反應生成氫氧根離子,所以溶液中鉀離子沒有參與反應,根據原子守恒知,KOH的物質的量不變濃度變大,故B錯誤;
C.負極電極反應式為H2-2e-+2OH-=2H2O,正極電極反應式為O2+2H2O+4e-=4OH-,反應的總方程式為2H2+O2=2H2O,故C正確;
D.n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根據化合價可知轉移電子0.2mol,故D正確.
故選B.
點評 本題考查了化學電源新型電池,根據正負極上得失電子確定電極,再結合電解質溶液酸堿性書寫電極反應式,如果電解質溶液呈酸性,則正負極電極反應就改變,為易錯點,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 新制氯水應保存在棕色瓶中 | B. | 少量金屬鈉保存在煤油中 | ||
| C. | 漂白粉可露置于空氣中保存 | D. | 液溴采用液封法保存 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ; B的結構簡式CH3CH2CHO;B的物質的量0.06mol;
; B的結構簡式CH3CH2CHO;B的物質的量0.06mol;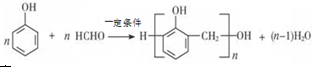 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 25℃時NH4Cl溶液的Kw大于100℃時NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反應的離子方程式為SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入鋁粉能產生氫氣的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃時,將pH=2的鹽酸與pH=12的NaOH溶液等體積混合,溶液呈中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
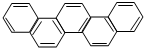 2015年,北京正在申辦冬奧會.有一種有機物因其酷似奧林克五環旗,科學家稱其為奧林匹克烴,下列有關奧匹克烴的說中正確的是( )
2015年,北京正在申辦冬奧會.有一種有機物因其酷似奧林克五環旗,科學家稱其為奧林匹克烴,下列有關奧匹克烴的說中正確的是( )| A. | 該物質屬于苯的同系物 | |
| B. | 該物質的一氯代物有一種 | |
| C. | 該物質完全燃燒生成水的物質的量小于二氧化碳的物質的量 | |
| D. | 該物質的分子中只含有非極性鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;實驗室制備氣體A的化學方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用離子方程式表示)
;實驗室制備氣體A的化學方程式2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑B的水溶液不呈中性的原因NH4++H2O?NH3.H2O+H+(用離子方程式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
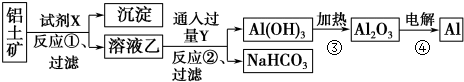
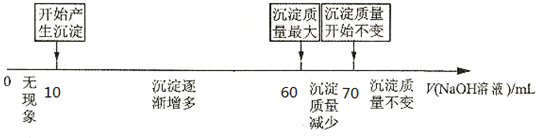
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲、乙、丙溶液中溶質的質量分數均大于5% | |
| B. | 甲溶液中溶質的質量分數小于5%,乙、丙溶液中溶質的質量分數大于5% | |
| C. | 甲溶液中溶質的質量分數小于5%,乙的大于5%,丙的等于5% | |
| D. | 甲、乙、丙溶液中溶質的質量分數均等于5% |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com