
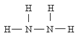 )可作為火箭發動機的燃料,NH3與NaClO反應可得到肼.
)可作為火箭發動機的燃料,NH3與NaClO反應可得到肼.分析 (1)實驗室用氯化銨和氫氧化鈣制備氨氣的化學方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)依據蓋斯定律:②×2-①得到:2N2H4(l)++N2O4(l)=3N2(g)+4H2O(g),反應熱與化學計量數成正比;
(3)反應中焓變等于反應物中鍵能之和-生成物中鍵能之和;
(4)NH3與NaClO反應可得到肼(N2H4),N元素的化合價升高,同時生成氯化鈉與水.
解答 解:(1)實驗室用氯化銨和氫氧化鈣制備氨氣的化學方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,
故答案為:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)①N2(g)+2O2(g)=N2O4(l)△H1=-195kJ?mol-1
②N2H4(l)+O2 (g)=N2(g)+2H2O(g)△H2=-534.2kJ•mol-1
根據蓋斯定律寫出肼和N2O4反應的熱化學方程:②×2-①得到:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
故答案為:2N2H4(l)+N2O4(l)=3N2(g)+4H2O(g)△H=-873.4kJ/mol;
(3)設斷裂1molN-H鍵所需的能量為x,
由反應及焓變等于反應物中鍵能之和-生成物中鍵能之和可知,
4x+154+498-942-2×2×464=-534,
解得x=403(kJ),
故答案為:403;
(4)NH3與NaClO發生氧化還原反應可得到肼(N2H4)、氯化鈉和水,所以該反應的化學方程式為2NH3+NaClO=N2H4+NaCl+H2O,
故答案為:2NH3+NaClO=N2H4+NaCl+H2O.
點評 本題考查了氧化還原反應、蓋斯定律的應用、燃料電池中電極反應式書寫等知識,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 組成元素相同,各元素質量分數也相同的不同物質屬于同系物 | |
| B. | 分子式相同的不同物質一定是同分異構體 | |
| C. | 相對分子質量相同的不同物質一定是同分異構體 | |
| D. | 通式相同的不同物質一定屬于同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 容器 | 甲 | 乙 | 丙 | |
| 反應物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
| 平衡 時數 據 | 反應能量變化的絕對值(kJ) | a | b | c |
| 反應物轉化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
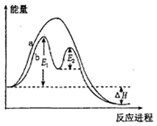
| A. | 反應過程a有催化劑參與 | |
| B. | 該反應為吸熱反應 | |
| C. | 改變催化劑,可改變該反應的活化能 | |
| D. | 有催化劑條件下,反應的活化能等于E1+E2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
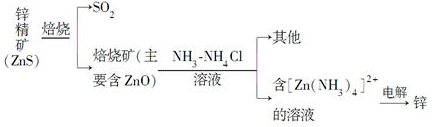
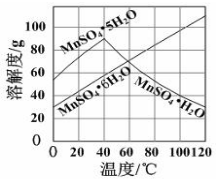
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | υ(H2)=0.1 mol•L-1•min-1 | B. | υ(N2)=0.2 mol•L-1•min-1 | ||
| C. | υ(NH3)=0.15 mol•L-1•min-1 | D. | υ(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com