
 由Cu、Zn、稀H2S04形成如下圖甲、乙裝置.試回答以下問題:
由Cu、Zn、稀H2S04形成如下圖甲、乙裝置.試回答以下問題:分析 (1)根據(jù)原電池的構成條件來回答;鋅銅、稀硫酸構成的原電池中,鋅易失電子發(fā)生氧化反應而作負極,銅作正極,電子從負極沿導線流向正極,電流流向與電子流向正好相反,正極上氫離子得電子發(fā)生還原反應,據(jù)此回答;
(2)鋅易失電子發(fā)生氧化反應而作負極,銅作正極,發(fā)生還原反應,據(jù)此回答;
(3)負極上鋅生成鋅離子進入溶液而導致質量減少,正極上氫離子得電子生成氫氣,所以正極質量不變,兩個電極減少的質量是鋅的質量,根據(jù)鋅和氫氣之間的關系式計算生成氫氣的體積.
解答 解:(1)A.不能構成回路,所以甲不是原電池,故A錯誤;
B.甲不是原電池,銅片表面不能出現(xiàn)氣體,乙裝置中銅片是正極,表面均有氣泡產(chǎn)生,故B錯誤;
C.兩燒杯中溶液中的氫離子均被消耗,所以溶液的pH均增大,故C正確;
D.乙裝置形成原電池,會加快反應速率,所以產(chǎn)生氣泡的速率甲中比乙中慢,故D正確;
E.乙裝置形成原電池,外電路中電流從正極流向負極,即電流方向Zn←Cu,故E錯誤.
故答案為:CD;
(2)乙裝置形成原電池,金屬鋅是負極,發(fā)生失電子的氧化反應,即Zn-2e-=Zn2+,銅是正極,發(fā)生的電子的還原反應,即2H++2e-=H2↑,
故答案為:Zn-2e-=Zn2+;2H++2e-=H2↑;
(3)負極上鋅生成鋅離子進入溶液而導致質量減少,正極上氫離子得電子生成氫氣,所以正極質量不變,兩個電極減少的質量是鋅的質量,鋅和稀硫酸反應離子方程式為2H++Zn=Zn2++H2↑,根據(jù)鋅和氫氣之間的關系式得氫氣的體積=$\frac{\frac{60g-47g}{65g/mol}}{1}$=4.48L,
故答案為:4.48L.
點評 本題考查原電池的工作原理,題目難度不大,注意兩極電極反應轉移的電子數(shù)目相等是計算的關鍵.


科目:高中化學 來源: 題型:解答題
 已知A,B,C,D,E五種元素的原子序數(shù)依次遞增,A,B,C,D位于前三周期,A位于周期表的s區(qū),其原子中電子層數(shù)和和未成對電子數(shù)相同;B的基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,且每種軌道中的電子總數(shù)相同;D原子的核外成對電子數(shù)是未成對電子數(shù)的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B二種元素組成的原子個數(shù)比為1:1的化合物N是常見的有機溶劑.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.
已知A,B,C,D,E五種元素的原子序數(shù)依次遞增,A,B,C,D位于前三周期,A位于周期表的s區(qū),其原子中電子層數(shù)和和未成對電子數(shù)相同;B的基態(tài)原子中電子占據(jù)三種能量不同的原子軌道,且每種軌道中的電子總數(shù)相同;D原子的核外成對電子數(shù)是未成對電子數(shù)的3倍.A、B、D三種元素組成的一種化合物M是新裝修居室中常含有的一種有害氣體,A、B二種元素組成的原子個數(shù)比為1:1的化合物N是常見的有機溶劑.E有“生物金屬”之稱,E4+離子和氬原子的核外電子排布相同.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C | Cl-Cl |
| 鍵能/kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 | 243 |
| A. | 表中最穩(wěn)定的共價鍵是Si-Si | |
| B. | Cl2(g)→2 Cl(g):△H=-243 kJ•mol | |
| C. | H2 (g)+Cl2(g)=2HCl(g):△H=-183 kJ•mol | |
| D. | 根據(jù)表中數(shù)據(jù)能計算出SiCl4(g)+2 H2(g)=Si(s)+4 HCl(1)的△H |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 3種 | B. | 4種 | C. | 5種 | D. | 7種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 至少6種 | B. | 4種 | C. | 3種 | D. | 2種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 某烯烴與氫氣加成得2,2-二甲基丁烷,該烯烴是2,2-二甲基-1-丁烯 | |
| B. | 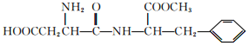 能發(fā)生水解反應,且與酸、堿均能反應 能發(fā)生水解反應,且與酸、堿均能反應 | |
| C. | 合成纖維、人造纖維及碳纖維都屬于有機高分子材料 | |
| D. | 為檢驗某鹵代烴中的鹵素原子,應取少量鹵代烴于試管中加入氫氧化鈉溶液煮沸,冷卻后加硝酸銀溶液,然后根據(jù)鹵化銀沉淀的顏色確定鹵素原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③⑥ | B. | ①③④⑤⑧ | C. | ①②③④⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 元素代號 | X | Y | Z | W | V |
| 原子半徑/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合價 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y與V位于同周期 | |
| B. | Y3+與V2-的核外電子數(shù)相等 | |
| C. | Y與W形成的化合物具有兩性 | |
| D. | Z的氫化物可與V的最高價氧化物的水溶液反應生成鹽 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com