
| A. | 60% | B. | 75% | C. | 80% | D. | 85% |
分析 n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根據方程式H2+2Li=2LiH、LiH+H2O=LiOH+H2↑得0.1mol氫氣反應生成LiH、LiH再和足量水反應后生成0.1mol氫氣,氫氧燃料堿性電池中負極反應式為H2-2e-+2OH-=2H2O,根據電極反應式知,0.2mol氫氣轉移電子物質的量=0.2mol×2=0.4mol,氫氧燃料電池的能量轉化率=$\frac{實際電子通過量}{理論電子通過量}×100%$.
解答 解:n(H2)=$\frac{2.24L}{22.4L/mol}$=0.1mol,根據方程式H2+2Li=2LiH、LiH+H2O=LiOH+H2↑得0.1mol氫氣反應生成LiH、LiH再和足量水反應后生成0.1mol氫氣,氫氧燃料堿性電池中負極反應式為H2-2e-+2OH-=2H2O,根據電極反應式知,0.2mol氫氣轉移電子物質的量=0.2mol×2=0.4mol,氫氧燃料電池的能量轉化率=$\frac{實際電子通過量}{理論電子通過量}×100%$=$\frac{0.32mol}{0.4mol}×100%$=80%,
故選C.
點評 本題考查化學方程式的有關計算,為高頻考點,側重考查學生分析計算能力,正確書寫方程式及明確各個物理量的關系式是解本題關鍵,注意氫氣反應生成LiH和LiH生成氫氣的物質的量不相等,為易錯點.


 考前必練系列答案
考前必練系列答案科目:高中化學 來源: 題型:推斷題
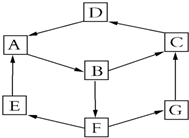 某興趣活動小組利用物質間的互變,設計成一個平面魔方,如圖所示:
某興趣活動小組利用物質間的互變,設計成一個平面魔方,如圖所示:| 純A(單質) | B溶液 | D固體 | G溶液 | |
| 顏色 | 銀白色 | 黃色 | 紅棕色 | 淺綠色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體區別與其他分散系的本質特征是分散質的粒子直徑在1-100nm之間 | |
| B. | 用平行光照射CuSO4溶液和氫氧化鐵膠體,可以加以區分 | |
| C. | 把FeCl3飽和溶液滴到NaOH溶液中,一制取氫氧化鐵膠體 | |
| D. | 樹林中的晨曦,該現象與丁達爾效應有關 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在氮化鋁的合成反應中,N2是還原劑,Al2O3是氧化劑 | |
| B. | 上述反應中每生成2 mol AlN,N2得到3 mol | |
| C. | 氮化鋁中氮元素的化合價為-3 | |
| D. | 氮化鋁晶體屬于分子晶體,熔點和沸點較低 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
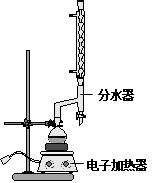 (改編)苯甲酸乙酯(C9H10O2)稍有水果氣味,用于配制香水香精和人造精油,大量用于食品工業中,也可用作有機合成中間體、溶劑等.其制備方法為:
(改編)苯甲酸乙酯(C9H10O2)稍有水果氣味,用于配制香水香精和人造精油,大量用于食品工業中,也可用作有機合成中間體、溶劑等.其制備方法為:
| 顏色、狀態 | 沸點(℃) | 密度(g•cm-3) | |
| 苯甲酸* | 無色、片狀晶體 | 249 | 1.2659 |
| 苯甲酸乙酯 | 無色澄清液體 | 212.6 | 1.05 |
| 乙醇 | 無色澄清液體 | 78.3 | 0.7893 |
| 環己烷 | 無色澄清液體 | 80.8 | 0.7318 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲基橙顯黃色的溶液:Na+、CO32-、NO3-、SO32- | |
| B. | 在由水電離出的c(H+)=1×10-12mol/L的溶液:Fe3+、ClO-、Na+、SO42- | |
| C. | 加入金屬鋁產生H2的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 飽和氯水中:Cl-、Na+、NO3-、SO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com