
【題目】氫氧燃料電池已用于航天飛機,它是以鉑作電極,以KOH溶液作電解質,下列敘述中不正確的是
A.H2在負極發生氧化反應
B.燃料電池的化學能可以全部轉化為電能
C.產物為無污染的水,屬于環境友好電池
D.供電時的總反應為:2H2 + O2 = 2H2O
 名校練考卷期末沖刺卷系列答案
名校練考卷期末沖刺卷系列答案科目:高中化學 來源: 題型:
【題目】A~H八種短周期主族元素在周期表中的相對位置如下圖所示,已知C元素形成的單質有“國防金屬”的美譽,E的最高價氧化物對應的水化物能與E的最簡單氫化物反應生成離子化合物。

(1)寫出B、G對應的元素符號______________ 。
(2)D元素在周期表中的位置為______________。
(3)B、E、F的簡單離子半徑由大到小的順序為______________(寫離子符號)。
(4)上述元素所形成的氣態單質中能用于飲用水消毒的是______________(寫化學式)。
(5)B的單質在F的單質中燃燒的火焰顏色為______________,所形成化合物的電子式為______________。
(6)C元素的單質可以在D和F組成的一種氣態化合物中燃燒,寫出該反應的化學方程式________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據氫原子和氟原子的核外電子排布,對F2和HF分子中形成的共價鍵描述正確的是
A. 兩者都為s-s σ 鍵 B. 兩者都為p-p σ 鍵
C. 前者為p-p σ 鍵,后者為s-p σ 鍵 D. 前者為s-s σ 鍵,后者為s-p σ 鍵
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在100℃時,將0.200 mol的四氧化二氮氣體充入2 L真空的密閉容器中,每隔一定的時間對該容器內的物質進行分析,得到如下表格:
| 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
試填空:
(1)該反應的化學方程式為N2O4![]() 2NO2 ,達到平衡時,四氧化二氮的轉化率為__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
2NO2 ,達到平衡時,四氧化二氮的轉化率為__________%,表中c2________c3、a______b(填“>”、“<”或“=”)。
(2) 20 s時四氧化二氮的濃度c1=________mol/L,在0 s~20 s時間段內,四氧化二氮的平均反應速率為________mol/(L·s)。
(3)若在相同情況下最初向該容器充入的是二氧化氮氣體,要達到上述同樣的平衡狀態,二氧化氮的起始濃度是________mol/L。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】I.根據下列敘述寫出相應的熱化學方程式:
(1)已知16 g固體硫完全燃燒時放出148.4 kJ的熱量,該反應的熱化學方程式是__________________________。
(2)下圖是198 K時N2與H2反應過程中能量變化的曲線圖。
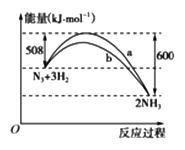
該反應的熱化學方程式為:_____________________。
(3)甲硅烷(SiH4)是一種無色氣體,遇到空氣能發生爆炸性自燃,生成SiO2和液態水。已知室溫下1 g甲硅烷自燃放出熱量44.6 kJ,其熱化學方程式是___________________。
II.
(1)事實證明,能設計成原電池的反應通常是放熱反應,下列化學反應在理論上可以設計成原電池的是_____________________。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.NaOH(aq)+HC1(aq)=NaC1(aq)+H2O(1) △H<0
C.2H2(g)+O2(g)=2H2O(1) △H<0
(2)以KOH溶液為電解質溶液,依據所選反應設計一個原電池,其負極反應為__________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、![]() 、
、![]() 、
、![]() 、
、![]() 是短周期元素,
是短周期元素,![]() 、
、![]() 、
、![]() 處于同一周期,
處于同一周期,![]() 元素的原子最外層電子數是次外層的2倍,
元素的原子最外層電子數是次外層的2倍,![]() 、
、![]() 、
、![]() 、
、![]() 具有相同電子層結構,下列說法正確的是( )
具有相同電子層結構,下列說法正確的是( )
A. 原子序數:![]() B. 原子半徑:
B. 原子半徑:![]() C. 最簡單氫化物的熱穩定性:
C. 最簡單氫化物的熱穩定性:![]() D. 離子半徑:
D. 離子半徑:![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】任何一個自發的氧化還原反應都可以設計成一個原電池。請根據:
Fe+CuSO4== Cu+FeSO4設計成一個原電池。
(1)該電池的負極材料為______,其電極反應為_______;
(2)正極材料為_____,電解質溶液為_____,其電極反應為___________________________。
(3)畫出裝置的簡圖,并注明正負極和電解質________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com