
直接排放含SO2的煙氣會形成酸雨,危害環境。某化學興趣小組進行如下有關SO2性質和含量測定的探究活動。
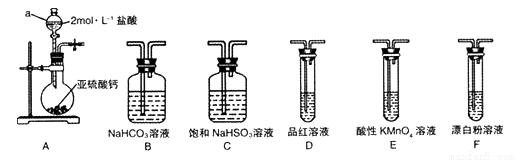
(1)裝置A中儀器a的名稱為__________。若利用裝置A中產生的氣體證明+4價的硫元素具有氧化性,試用化學方程式表示該實驗方案的反應原理________________。
(2)選用圖4中的裝置和藥品探究亞硫酸與次氯酸的酸性強弱:
①甲同學認為按A→C→F→尾氣處理順序連接裝置可以證明亞硫酸和次氯酸的酸性強弱,乙同學認為該方案不合理,其理由是_________________。
②丙同學設計的合理實驗方案為:按照A→C→_________→F→尾氣處理(填字母) 順序連接裝置。證明亞硫酸的酸性強于次氯酸的酸性的實驗現象是_____________________。
③其中裝置C的作用是__________。常溫下,測得裝置C中飽和NaHSO3溶液的pH≈5,則該溶液中所有離子的濃度由大到小的順序為__________________。(已知0.1mol/L的H2SO3溶液pH >1)
(3)為了測定裝置A殘液中SO2的含量,量取10.00 mL殘液于圓底燒瓶中,加熱使SO2 全部蒸出,用20.00 mL0.0500 mol/L的KMnO4溶液吸收。充分反應后,再用0.2000mol/L的KI標準溶液滴定過量的KMnO4 ,消耗KI溶液15.00 mL。
已知:5SO2+2MnO4-+2H2O=2Mn2++5SO42-+4H+
10I-+2MnO4-+16H+=2Mn2++5I2+8H2O
①殘液中SO2的含量為_______g·L-1。
②若滴定過程中不慎將KI標準溶液滴出錐形瓶外少許,使測定結果_______(填“偏高”、“偏低”或“無影響”)。
 天天向上課時同步訓練系列答案
天天向上課時同步訓練系列答案 陽光課堂同步練習系列答案
陽光課堂同步練習系列答案科目:高中化學 來源:2016-2017學年遼寧省北校高一3月月考化學試卷(解析版) 題型:選擇題
已知W、X、Y、Z為短周期元素,W、Z同主族,X、Y、Z同周期,W的氣態氫化物的穩定性大于Z的氣態氫化物的穩定性,X、Y為金屬元素,X的陽離子的氧化性小于Y的陽離子的氧化性。下列說法正確的是( )
A. X、Y、Z、W的原子半徑依次減小
B. W與X形成的化合物中只含離子鍵
C. W的氣態氫化物的沸點一定高于Z的氣態氫化物的沸點
D. 若W與Y的原子序數相差5,則二者形成化合物的化學式一定為Y2W3
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省南通市高三高考全真模擬(二)化學試卷(解析版) 題型:選擇題
《中華人民共和國安全生產法》指出安全生產工作應當以人為本,堅持安全發展、預防為主、綜合治理的方針。下列做法不正確的是( )
A. 面粉生產車間應嚴禁煙火 B. NH3泄露時向空中噴灑水霧
C. 含Cl2的尾氣用堿溶液處理后再排放 D. 金屬鈉失火時應立即用大量冷水撲滅
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省淮北市高二下學期第一次月考化學試卷(解析版) 題型:選擇題
在某溫度時,將nmol/L氨水滴入10mL1.0mol/L鹽酸中,溶液pH和溫度隨加入氨水體積變化曲線如圖所示。下列有關說法正確的是
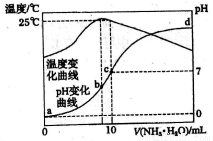
A. a點Kw=1.0×10-14
B. 水的電離程度:c>b>a>d
C. b點:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D. 25℃時,氨水的電離平衡常數K=10-7/(10n-1)mol/L
查看答案和解析>>
科目:高中化學 來源:2016-2017學年安徽省淮北市高二下學期第一次月考化學試卷(解析版) 題型:選擇題
元素周期表中鉍元素的數據見下圖,下列說法正確的是

A. Bi元素的質量數是83 B. Bi元素的相對原子質量是209.0
C. Bi原子6p能級有一個未成對電子 D. Bi原子最外層有5個能量相同的電子
查看答案和解析>>
科目:高中化學 來源:2017屆內蒙古包頭市高三下學期第一次模擬考試理綜化學試卷(解析版) 題型:選擇題
分子式為C7H6Cl2的芳香族化合物共有(不含立體異構體)( )
A. 6種 B. 9種 C. 10 種 D. 12 種
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高一下學期第一次月考化學試卷(解析版) 題型:填空題
短周期元素的單質X、Y、Z在通常狀況下均為氣態,并存在下列轉化關系(反應條件略去):
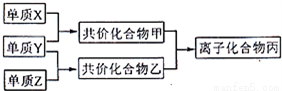
已 知:在常見雙原子單質分子中,X分子含共價鍵最多;甲分子含10個電子,乙分子含18個電子.
知:在常見雙原子單質分子中,X分子含共價鍵最多;甲分子含10個電子,乙分子含18個電子.
回答下列問題:
(1)X的電子式是_________.
(2)實驗室可用圖1所示裝置(缺少收集裝置,夾持固定裝置略去)制備并收集甲.
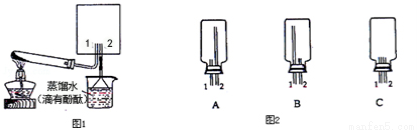
①從裝置(圖2)中選出圖1方框內收集甲的裝置是__________.
②試管中發生的化學反應方程式是 ________________________.
③燒杯中溶液由無色變為紅色,其原因是(用電離方程式表示)__________________。
查看答案和解析>>
科目:高中化學 來源:2016-2017學年江西省高一下學期第一次月考化學試卷(解析版) 題型:選擇題
元素的原子結構決定其性質和周期表中的位置.下列說法正確的是( )
A. 元素原子的最外層電子數等于元素的最高化合價
B. 多電子原子中,在離核較近的區域內運動的電子能量較高
C. 元素周期表中位于金屬和非金屬分界線附近的元素屬于過渡元素
D. Si、P、S得電子能力和最高價氧化物對應水化物的酸性均依次增強
查看答案和解析>>
科目:高中化學 來源:2017屆江蘇省南通市高三高考全真模擬(五)化學 試卷(解析版) 題型:填空題
以NaCl等為原料制備KClO4的過程如下:
①在無隔膜、微酸性條件下,發生反應:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl發生復分解反應,降溫結晶,得KClO3。
③一定條件下反應:4KClO3=3KClO4+KCl,將產物分離得到KClO4。
(1)電解時,產生質量為2.13g NaClO3,同時得到H2的體積為____________L(標準狀況)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。
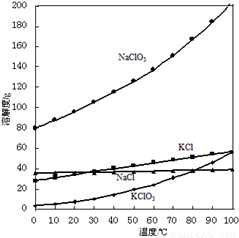
(3)該過程制得的KClO4樣品中含少量KCl雜質,為測定產品純度進行如下實驗:
準確稱取5.689g樣品溶于水中,配成250mL溶液,從中取出25.00mL于錐形瓶中,加入適量葡萄糖,加熱使ClO4-全部轉化為Cl- (反應為:3 KClO4 +C6H12O6 ═ 6 H2O + 6 CO2↑ + 3 KCl),加入少量K2CrO4溶液作指示劑,用0. 20mol/L AgNO3溶液進行滴定至終點,消耗AgNO3溶液體積21.00mL。滴定達到終點時,產生磚紅色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,則此時c(Cl-)=________________mol/L。
② 計算KClO4樣品的純度(請寫出計算過程。)______________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com