
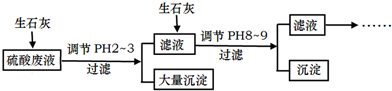
分析 硫酸廢液中含有大量硫酸外,還含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,調節pH2~3,大量沉淀主要成分為CaSO4•2H2O[含有少量Fe(OH)3],濾液加入生石灰調節pH8~9,生成Ca3(AsO4)2沉淀,濾液主要含有(NH4)2SO4和NH4Cl,
(1)硫酸的濃度為4.9g•L-1,結合c=$\frac{n}{V}$=$\frac{\frac{m}{M}}{V}$計算;
(2)根據c(NH4+)越大,NH4+水解程度越小判斷;
(3)隨著向廢液中投入生石灰,c(OH-)增大,c(NH3•H2O)減小;
(4)提純CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,并洗滌、干燥;
(5)①H3AsO4是弱酸電離出來的AsO43-較少,所以酸性條件下不易形成Ca3(AsO4)2沉淀;
②依據水解常數與電離常數及Kw的關系計算;
③根據還原劑還原性大于還原產物的還原性判斷.
解答 解:硫酸廢液中含有大量硫酸外,還含有少量NH4+、Fe3+、AsO43-、Cl-,加入生石灰,調節pH2~3,大量沉淀主要成分為CaSO4•2H2O[含有少量Fe(OH)3],濾液加入生石灰調節pH8~9,生成Ca3(AsO4)2沉淀,濾液主要含有(NH4)2SO4和NH4Cl,
(1)硫酸的濃度為4.9g•L-1,c(H2SO4)=$\frac{\frac{4.9g}{98g/mol}}{1L}$=0.05mol/L,c(H+)=0.1mol/L,pH=-lg0.1=1,故答案為:1;
(2)如c[(NH4)2SO4]=c(NH4Cl),則(NH4)2SO4溶液中c(NH4+)較大,因c(NH4+)越大,NH4+水解程度越小,則(NH4)2SO4溶液中c(NH4+)小于是NH4Cl溶液中c(NH4+)的2倍,如等于2倍,則c(NH4Cl)應較大,
故答案為:<;
(3)隨著向廢液中投入生石灰,c(OH-)增大,c(NH3•H2O)減小,則溶液中$\frac{c(N{H}_{3}.{H}_{2}O)}{c(O{H}^{-})}$減小,故答案為:減小;
(4)提純CaSO4•2H2O,可加入稀硫酸溶解Fe(OH)3,且防止CaSO4•2H2O的溶解,過濾后洗滌、干燥,
故答案為:稀硫酸;晾干或干燥;
(5)①H3AsO4是弱酸電離出來的AsO43-較少,所以酸性條件下不易形成Ca3(AsO4)2沉淀,當溶液中pH調節到8左右時AsO43-濃度增大,Ca3(AsO4)2開始沉淀,
故答案為:H3AsO4是弱酸,當溶液中pH調節到8左右,c(AsO43-)增大,Ca3(AsO4)2開始沉淀;
②Na3AsO4的第一步水解的離子方程式為:AsO43-+H2O?HAsO42-+OH-,該步水解的平衡常數Kh=$\frac{c(HAs{{O}_{4}}^{2-})}{c(As{{O}_{4}}^{3-})}$=$\frac{c(HAs{{O}_{4}}^{2-}).c(O{H}^{-}).c({H}^{+})}{c(As{{O}_{4}}^{3-}).c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{3}}$=$\frac{1{0}^{-14}}{4.0×1{0}^{-12}}$=2.5×10-3,
故答案為:2.5×10-3;
③已知:AsO43-+2I-+2H+=AsO33-+I2+H2O,SO2+I2+2H2O=SO42-+2I-+4H+.還原劑還原性大于還原產物的還原性,則還原性SO2>I->AsO33-,兩個反應中還原性最強的微粒是SO2,
故答案為:SO2.
點評 本題考查較為綜合,側重于學生的分析、實驗和計算能力的考查,明確沉淀溶解平衡的溶度積常數、水解常數和電離常數的計算及離子方程式的書寫和沉淀的形成等是解本題關鍵,考查的知識點較多,題目難度中等.


 暑假作業海燕出版社系列答案
暑假作業海燕出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 56克亞鐵離子得到2NA個電子被還原成單質 | |
| B. | 1L 1mol/L的KCl溶液中含Cl-的物質的量為NA | |
| C. | 在25℃、1.01×105Pa的條件下,2.24LCO2中含有的原子數大于0.3NA | |
| D. | 0.1mol/L的氯化鋇溶液中氯離子的數目是0.2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鈉與氧氣反應時,產物只有一種 | |
| B. | 鋁箔在空氣中受熱可以熔化且會發生劇烈燃燒 | |
| C. | 金屬與非金屬發生反應時,被氧化的一定是金屬 | |
| D. | 鐵絲不論在空氣中還是純氧中都不會燃燒 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3固體可以用FeSO4溶液在蒸發皿中加熱蒸干獲得 | |
| B. | 可用碳酸氫銨溶液鑒別稀鹽酸、氫氧化鈉溶液、氯化鋁溶液 | |
| C. | 用稀硝酸檢驗氫氣還原氧化銅所生成的紅色固體中含有氧化亞銅 | |
| D. | 測定相同條件下鹽酸和磷酸溶液的pH,證明非金屬性:Cl>P |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 體系的壓強不再發生變化 | |
| B. | v(CO2)=v(H2O) | |
| C. | 生成n mol CH3OH的同時生成n mol H2O | |
| D. | 3 mol H-H鍵斷裂的同時斷裂2 mol H-O鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 制取氣體 | 雜質氣體 | 制取氣體的發生裝置 | 除去雜質氣體的凈化裝置 | 收集裝置 | 凈化裝置內 所用試劑 | 檢驗制得氣體所用試劑 |
| NH3 | H2O(g) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 沼氣、煤炭、石油 | B. | 海洋能、地熱能、核能 | ||
| C. | 天然氣、水能、生物能 | D. | 風能、太陽能、潮汐能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com