
| A. | ①② | B. | ①③ | C. | ①④ | D. | ①②③④ |
分析 ①溫度不變,水的離子積常數不變;
②強酸弱堿鹽溶液中氫離子為水電離出的氫離子;
③根據溶液酸堿性再結合電荷守恒判斷離子濃度大小;
④NH4Cl水解,可促進水的電離.
解答 解:①25℃時,某NH4Cl溶液的pH為4,則溶液中c(H+)>c(OH-),故正確;
②強酸弱堿鹽溶液中氫離子為水電離出的氫離子,氯化銨為強酸弱堿鹽,所以溶液中水電離出的氫離子濃度為1×10-4mol/L,故錯誤;
③溶液呈酸性,所以c(H+)>c(OH-),溶液中存在電荷守恒c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)>c(NH4+),鹽類水解程度較小,所以c(NH4+)>c(H+),則溶液中離子濃度大小順序是c(Cl-)>c(NH4+)>c(H+)>c(OH-),故正確;
④NH4Cl水解,可促進水的電離,故錯誤.
故選B.
點評 本題考查了鹽類水解,根據溶液酸堿性再結合電荷守恒來分析解答,難點是計算鹽溶液中水電離出的氫離子或氫氧根離子濃度.


科目:高中化學 來源: 題型:選擇題
 一種碳納米管能夠吸附氫氣,可做二次電池(如圖所示)的碳電極.該電池的電解質為6mol/LKOH溶液,下列說法正確的是( )
一種碳納米管能夠吸附氫氣,可做二次電池(如圖所示)的碳電極.該電池的電解質為6mol/LKOH溶液,下列說法正確的是( )| A. | 放電時鎳電極反應為:NiO(OH)+H2O+e-=Ni(OH)2+OH- | |
| B. | 放電時OH-移向鎳電極 | |
| C. | 充電時碳電極反應為H2-2e-+2OH-=2H2O | |
| D. | 充電時將碳電極與電源的正極相連 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | a、c兩元素處在元素周期表的VIA族 | |
| B. | b、d兩種元素可組成化學式為d2b2的化合物,且陰陽離子個數比為1:2 | |
| C. | c單質可在b單質中燃燒生成的化合物的分子式為cb2 | |
| D. | c的單質可用來制作光導纖維 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
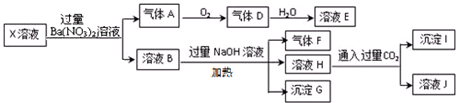
| A. | X中肯定存在Fe2+、A13+、NH4+、C1- | |
| B. | X中不能確定的離子是 K+和C1- | |
| C. | 沉淀G在空氣中放置過程中,沉淀顏色會由白色變為灰綠色最后變為紅褐色 | |
| D. | 標準狀況下將一試管D氣體倒扣在水槽中充分吸收(假設所得溶液沒有擴散),所得溶液物質的量濃度約為0.036mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| ① | He-268.8 | (a)-249.5 | Ar-185.8 | Kr 151.7 |
| ② | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| ③ | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| ④ | H2O 100.0 | H2S-60.0 | (d)-42.0 | H2Te-1.8 |
| A. | a、b、c、d的化學式分別為Ne、Br2、HF、H2Se | |
| B. | 系列②中各物質均只有強氧化性 | |
| C. | 系列④中各化合物的穩定性順序為:H2O>H2S>d>H2Te | |
| D. | 系列③中各物質對應物質水溶液的酸性和還原性均逐漸增強 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X與Y形成的兩種化合物中陰、陽離子的個數比均為1:2,且均能與水反應 | |
| B. | 根據非金屬性強弱,不可能由Z的最高價氧化物制出W的最高價氧化物 | |
| C. | Y的簡單氫化物的沸點和熱穩定性均大于R的簡單氫化物 | |
| D. | 向兩份BaCl2溶液中分別通入RY2、WY2,均無白色沉淀生成,但一段時間后,通入RY2的一份中可能產生沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
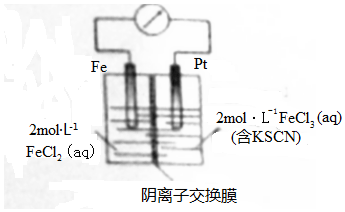
| A. | 電子由鐵極經溶液向鉑極遷移 | |
| B. | 放電過程中交換膜右側溶液顏色逐漸變淺 | |
| C. | 正極的電極反應式為Fe3++3e-=Fe | |
| D. | 若轉移2mole-,交換膜右側溶液中約減少3mol離子 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com