
【題目】氫氧化鋰(LiOH)是重要的初加T鋰產品之一,可用于繼續生產氟化鋰、錳酸鋰等,用天然鋰輝石(主要成分LiAISi2O3,含有Fe (III)等雜質)生產LiOH的一種工藝流程如圖所示:
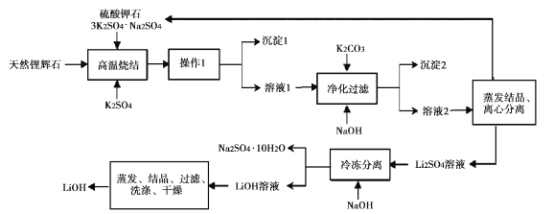
已知溶液1中含有Li+、K+、A13+、Na+、Fe3+、SO42-等離子,請回答相關問題。
(l)將LiAlSi2O6改寫為氧化物的形式:____。
(2)高溫燒結的目的是____。操作1是 __ 。
(3)凈化過濾過程中溶液的pH不能過低也不能過高,原因是____。
(4)流程中的某種物質可循環利用,該物質的化學式是____。
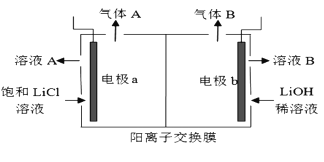
(5)工業生產中通過電解LiCI溶液的方法也可制得LiOH,其原理如圖所示,電極a應連接電源的____(選填“正極”或“負極”),電極b發生的反應是 ___,陽離子交換膜的作用是___
【答案】Li2OAl2O34SiO2 將鋰輝石轉化為可溶性硫酸鹽,與雜質分離 溶解、過濾 pH過低Al3+和Fe3+不能完全除去,pH過高會使生成的Al(OH)3部分溶解 3K2SO4Na2SO4 正極 2H2O+2e-=H2↑+2OH- 可以防止OH-進入左室與Cl2反應,還可以讓更多的Li+進入右室得到高濃度的LiOH
【解析】
(1)將硅酸鹽改為氧化物形式的方法為;依次將各元素寫成氧化物形式,中間用“”連接,同時注意氧化物的先后順序,LiAlSi2O6改寫為氧化物的形式為:Li2OAl2O34SiO2。
答案為:Li2OAl2O34SiO2。
(2)由操作1前后物質的狀態可知,操作1應該是溶解、過濾,根據所得溶液1里的成分全部為可溶性硫酸鹽電離產生的離子可以確定,高溫燒結的目的一個是為了除去雜質,另外更重要的就是將礦石中難溶成分轉化為可溶成分,再通過后續操作進行分離。
答案為:將鋰輝石轉化為可溶性硫酸鹽,與雜質分離;溶解、過濾。
(3)凈化操作中加入NaOH溶液,目的是為了將溶液里的雜質離子Fe3+、Al3+轉化為沉淀除去,pH過低雜質不能完全除去,而pH過高,NaOH濃度太大,又能使生成的Al(OH)3部分溶解,所以需要控制溶液的pH在一定的范圍。
答案為:pH過低Al3+和Fe3+不能完全除去,pH過高會使生成的Al(OH)3部分溶解。
(4)根據題詞信息可知,可以循環使用的物質是:3K2SO4Na2SO4。
答案為:3K2SO4Na2SO4。
(5)據圖可知電解池兩極均有氣體產生,則兩極反應為:陽極:2Cl--2e-=Cl2↑,陰極:2H2O+2e-=H2↑+2OH-,由右室通入LiOH稀溶液可知,溶液B為制得的LiOH溶液,右室為陰極區,電極b與電源負極相連,則左室為陽極區,電極a與電源正極相連,電極b上的反應為:2H2O+2e-=H2↑+2OH-;陽離子交換膜可以防止OH-進入左室與Cl2反應,還可以讓更多的Li+進入右室得到高濃度的LiOH。
答案為:正極;2H2O+2e-=H2↑+2OH-;可以防止OH-進入左室與Cl2反應,還可以讓更多的Li+進入右室得到高濃度的LiOH。


 口算題天天練系列答案
口算題天天練系列答案科目:高中化學 來源: 題型:
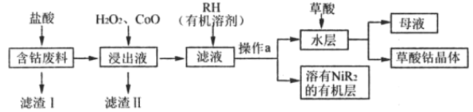
【題目】草酸鈷是制備高品質鈷氧化物和單質鈷粉的重要中間產品。用含鈷廢料(主要成分為Co,含有一定量的Ni、Al2O3、Fe、SiO2等)可以制備草酸鈷晶體(CoC2O4·2H2O)。一種制備方法是選擇草酸做沉淀劑,工業流程如圖。
己知:①相關金屬離子以氫氧化物形式沉淀完全的pH如下:
金屬離子 | Fe3+ | Al3+ | Co2+ | Fe2+ | Ni2+ |
沉淀完全的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.5 |
②CoC2O4+2C2O![]()
![]() [Co(C2O4)3]4-。
[Co(C2O4)3]4-。
回答下列問題:
(1)CoC2O4中Co的化合價是___。
(2)浸出液中含有的陽離子除了H+、Co2+外,還有___。
(3)濾渣II的主要成分有___(填化學式)。
(4)加入RH的目的是___,操作a的名稱是___。
(5)用一定濃度的草酸沉淀Co2+時,lg[Co]T,隨溶液pH變化如圖所示([Co]T表示Co以非沉淀形式存在的各種形態濃度之和)。
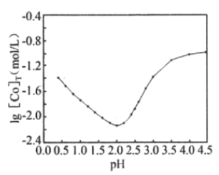
①沉淀Co2+時,應控制pH在___。
②lg[Co]T隨pH的增大先減小后增大的原因為___。
(6)母液經氯氣氧化后溶液中的鹽酸可以循環使用,寫出母液與氯氣反應的化學方程式___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】色酮類化合物K具有抗菌、降血脂等生理活性,其合成路線如下:
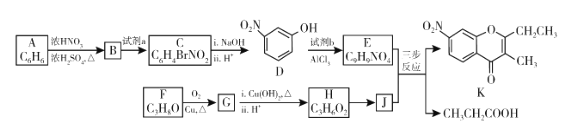
已知:
①
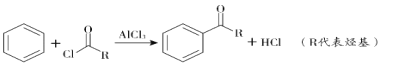
②
![]()
③
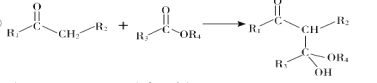
(![]() 代表烴基)
代表烴基)
(1)A的結構簡式是_________;根據系統命名法,F的名稱是__________。
(2)B→C所需試劑a是__________;試劑b的結構簡式是_________。
(3)C與足量的![]() 反應的化學方程式為__________。
反應的化學方程式為__________。
(4)G與新制![]() 反應的化學方程式為__________。
反應的化學方程式為__________。
(5)已知:①![]() ;②J分子中有兩種化學環境不同的氫以E和J為原料合成K分為三步反應,寫出有關化合物的結構簡式:__________
;②J分子中有兩種化學環境不同的氫以E和J為原料合成K分為三步反應,寫出有關化合物的結構簡式:__________
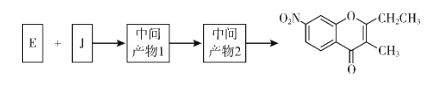
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在4 L密閉容器中充入6 mol A氣體和5 mol B氣體,在一定條件下發生反應:3A(g)+B(g)![]() 2C(g)+xD(g),達到平衡時,生成了2 mol C,經測定,D的濃度為0.5 mol·L-1,下列判斷正確的是( )。
2C(g)+xD(g),達到平衡時,生成了2 mol C,經測定,D的濃度為0.5 mol·L-1,下列判斷正確的是( )。
A. x=1
B. B的轉化率為20%
C. 平衡時A的濃度為1.50 mol·L-1
D. 達到平衡時,在相同溫度下容器內混合氣體的壓強是反應前的85%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】無水四氯化錫(SnC14)是一種用途廣泛的化工中間體,常用作媒染劑和有機合成的氯化催化劑。熔融的金屬錫(熔點231℃)在300℃左右能直接與Cl2作用生成無水四氯化錫,實驗室裝置如圖所示:

已知信息如下:①將金屬錫熔融,通人干燥氯氣進行反應,生成四氯化錫。②無水四氯化錫是無色易流動的液體,熔點為一33℃,沸點為114.1℃。二氯化錫是無色晶體,熔點為246℃,沸點為652℃。③無水四氯化錫在空氣中極易水解,水解產物之一是SnO2.xH2O,并產生白煙。請回答下列問題:
(l)開始實驗前一定要____,E中冷水的作用是 ___。
(2)裝置F中盛放的最佳試劑為 ___,作用是____。
(3)實驗時應先打開A處分液漏斗旋塞和整套裝置的閥門,待觀察到____這一現象時,再點燃D處酒精燈。
(4)若撤去裝置C,則D中還可能發生反應的化學方程式為 __。
(5) Cl2和錫作用即可生成SnC14,也會生成SnCl2,為減少SnCl2的生成,可采取的措施是 _______ .
(6)得到的產物中常含有雜質SnCl2,SnCl2是常用的還原劑。某實驗小組用碘氧化法滴定分析產品中雜質SnCl2的質量分數。準確稱取a克該樣品于錐形瓶,用適量濃鹽酸溶解,淀粉溶液作指示劑,c mol.L-l碘標準溶液滴定至終點,消耗標準液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,則產品中雜質SnCl2的質量分數為____(用含a、c的代數式表示);即使此法測定的操作均正確,但測得的SnCl2含量仍低于實際含量,其原因可能是________(用離子方程式表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定條件下,在密閉容器中,能表示反應X(g)+2Y(g) ![]() 2Z(g)一定達到化學平衡狀態的是( )
2Z(g)一定達到化學平衡狀態的是( )
①X、Y、Z的物質的量之比是1∶2∶2
②X、Y、Z的濃度不再發生變化
③容器中的壓強不再發生變化
④單位時間內生成n mol Z,同時生成2n mol Y
A. ①②B. ①④C. ②③D. ③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】2020年5月1日北京市在全市范圍內開展施行垃圾分類,下列垃圾分類不正確是( )
A.魚骨、菜葉 | B.消毒劑及其包裝物 | C.破損的易拉罐 | D.破碎玻璃 |
|
|
|
|
廚余垃圾 | 有害垃圾 | 可回收垃圾 | 其他垃圾 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子方程式能用來解釋相應實驗現象的是( )
A.氫氧化鎂懸濁液中滴加氯化銨溶液,沉淀溶解:Mg(OH)2+2NH![]() =Mg2++2NH3·H2O
=Mg2++2NH3·H2O
B.沸水中滴加飽和氯化鐵溶液得到紅褐色液體:Fe3++3H2O=Fe(OH)3↓+3H+
C.用食醋能清洗水垢:CO![]() +2CH3COOH=2CH3COO-+H2O+CO2↑
+2CH3COOH=2CH3COO-+H2O+CO2↑
D.84消毒液與潔廁靈混用產生有毒氣體:ClO-+Cl-+2H+=Cl2↑+OH-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)2012年倫敦奧運會火炬采用丙烷為燃料。丙烷熱值較高,污染較小,是一種優良的燃料。試回答下列問題:

①如圖是一定量丙烷完全燃燒生成CO2和1 mol H2O(l)過程中的能量變化圖,請在圖中的括號內填入“+”或“-”。
②寫出表示丙烷燃燒熱的熱化學方程式:___________________________________。
③二甲醚(CH3OCH3)是一種新型燃料,應用前景廣闊。1 mol二甲醚完全燃燒生成CO2和液態水放出1 455 kJ熱量。若1 mol丙烷和二甲醚的混合氣體完全燃燒生成CO2和液態水共放出1 645 kJ熱量,則混合氣體中,丙烷和二甲醚的物質的量之比為________。
(2)蓋斯定律認為:不管化學過程是一步完成或分幾步完成,整個過程的總熱效應相同。試運用蓋斯定律回答下列問題:
①已知:H2O(g)=H2O(l) ΔH1=-Q1 kJ/mol C2H5OH(g)=C2H5OH(l) ΔH=-Q2 kJ/mol
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3 kJ/mol
若使46 g液態無水酒精完全燃燒,并恢復到室溫,則整個過程中放出的熱量為________kJ。
②碳(s)在氧氣供應不充足時,生成CO同時還部分生成CO2,因此無法通過實驗直接測得反應: C(s)+![]() O2(g)=CO(g)的ΔH。但可設計實驗、利用蓋斯定律計算出該反應的ΔH,計算時需要測得的實驗數據有________。
O2(g)=CO(g)的ΔH。但可設計實驗、利用蓋斯定律計算出該反應的ΔH,計算時需要測得的實驗數據有________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com