
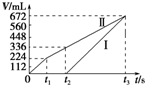
 常溫下電解200mL一定濃度的NaCl與CuSO4混合溶液,理論上兩極所得氣體的體積隨時間變化的關系如圖中Ⅰ、Ⅱ所示(氣體體積已換算成標準狀況下的體積),根據圖中信息進行下列計算:(要求寫出計算步驟)
常溫下電解200mL一定濃度的NaCl與CuSO4混合溶液,理論上兩極所得氣體的體積隨時間變化的關系如圖中Ⅰ、Ⅱ所示(氣體體積已換算成標準狀況下的體積),根據圖中信息進行下列計算:(要求寫出計算步驟)分析 電解200mL一定濃度的NaCl與CuSO4混合溶液,陽極發生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,陰極發生Cu2++2e-=Cu、2H++2e-=H2↑,結合圖可知,Ⅰ為陰極氣體體積與時間的關系,Ⅱ為陽極氣體體積與時間的關系,以此來計算.
解答 解:電解200mL一定濃度的NaCl與CuSO4混合溶液,陽極發生2Cl--2e-=Cl2↑、4OH--4e-=O2↑+2H2O,陰極發生Cu2++2e-=Cu、2H++2e-=H2↑,結合圖可知,Ⅰ為陰極氣體體積與時間的關系,Ⅱ為陽極氣體體積與時間的關系,
(1)由圖可知,產生氯氣為224mL,則由2Cl--2e-=Cl2↑可知,n(NaCl)=$\frac{0.224L}{22.4L/mol}$×2=0.02mol,所以c(NaCl)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
由t2時生成氧氣為112mL,n(O2)=$\frac{0.112L}{22.4L/mol}$=0.005mol,則共轉移電子為0.02mol+0.005mol×4=0.04mol,
根據電子守恒及Cu2++2e-=Cu可知,n(CuSO4)=$\frac{0.04mol}{2}$=0.02mol,所以c(CuSO4)=$\frac{0.02mol}{0.2L}$=0.1mol/L,
答:原混合溶液NaCl和CuSO4的物質的量濃度均為0.1mol/L;
(2)電解至t3時,電解生成氧氣為672-224mL=448mL,均來源于水,由2H2O$\frac{\underline{\;電解\;}}{\;}$O2↑+2H2↑,n(H2O)=$\frac{0.448L}{22.4L/mol}$×2=0.04mol,所以電解水的質量為0.04mol×18g/mol=0.72g,答:電解至t3時,消耗水的質量為0.72g.
點評 本題考查電解原理,明確發生的電極反應及圖圖象的對應關系是解答本題的關鍵,注意(2)中計算電解水的質量可利用生成氧氣的體積直接計算,題目難度中等.


 心算口算巧算一課一練系列答案
心算口算巧算一課一練系列答案 應用題作業本系列答案
應用題作業本系列答案科目:高中化學 來源: 題型:選擇題

| M | N | R | |
| A | 鋅 | 銅 | 稀硫酸 |
| B | 鐵 | 銅 | FeCl3溶液 |
| C | 鐵 | 銀 | 硝酸銀 |
| D | 銅 | 鐵 | CuSO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 某溫度時,在5L的容器中,X、Y、Z三種氣體的物質的量隨時間的變化曲線如圖所示.請通過計算回答下列問題:
某溫度時,在5L的容器中,X、Y、Z三種氣體的物質的量隨時間的變化曲線如圖所示.請通過計算回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 共價鍵只有方向性 | |
| B. | 離子晶體中只存在陰陽離子間的靜電吸引力 | |
| C. | Na2O2中陰陽離子個數比為1:2 | |
| D. | 化學式CO2、SiO2、NaCl、CaH2都可以表示分子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 汽車尾氣中含有NO、CO和碳顆粒等有害物質,已成為某些大城市空氣的主要污染源.
汽車尾氣中含有NO、CO和碳顆粒等有害物質,已成為某些大城市空氣的主要污染源. 2NO;汽車啟動后,汽缸內溫度越高,單位時間內NO排放量越大,試分析其原因溫度升高,反應速率加快.
2NO;汽車啟動后,汽缸內溫度越高,單位時間內NO排放量越大,試分析其原因溫度升高,反應速率加快.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

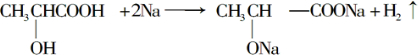 ;
; ;
;查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | X與Y只能形成一種化合物 | |
| B. | 原子半徑:r(Y)<r(W)<r(Z) | |
| C. | W的簡單氣態氫化物的熱穩定性比Y的強 | |
| D. | Z的最高價氧化物對應的水化物是酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com