
【題目】求下列溶液的pH(常溫條件下)(已知lg2=0.3)
(1)0.005 mol·L-1的H2SO4溶液________
(2)已知CH3COOH的電離常數Ka=1.8×10-5,0.1 mol·L-1的CH3COOH溶液________
(3)0.1 mol·L-1NH3·H2O溶液(NH3·H2O的電離度為α=1%,電離度=![]() ×100%)________
×100%)________
(4)將pH=8的NaOH與pH=10的NaOH溶液等體積混合________
(5)常溫下,將pH=5的鹽酸與pH=9的NaOH溶液以體積比11∶9混合________
(6)將pH=3的HCl與pH=3的H2SO4等體積混合________
(7)0.001 mol·L-1的NaOH溶液________
(8)pH=2的鹽酸與等體積的水混合________
(9)pH=2的鹽酸加水稀釋到1 000倍________
【答案】2 2.9 11 9.7 6 3 11 2.3 5
【解析】
(1)根據硫酸化學式可知c(H+)與硫酸濃度的關系,根據pH=-lg[c(H+)]計算該溶液的pH;
(2)根據醋酸的電離平衡常數等于醋酸根離子濃度和氫離子濃度乘積與醋酸濃度的比值來計算;
(3)根據電離度計算出0.1mol.L-1的NH3H2O溶液中氫氧根離子濃度,然后計算出其pH;
(4)將pH=8的NaOH與pH=10的NaOH溶液等體積混合,先計算出混合液中氫氧根離子濃度,然后計算出氫離子濃度及溶液的pH;
(5)常溫下,將pH=5的鹽酸與pH=9的NaOH溶液以體積比11:9混合,酸過量,計算出混合液中氫離子濃度,再計算出混合液的pH;
(6)將pH=3的HCl與pH=3的H2SO4等體積混合,混合液的pH不變;
(7)0.001molL-1的NaOH溶液,先計算出溶液中氫離子濃度,再計算出溶液的pH;
(8)pH=2的鹽酸與等體積的水混合,先根據溶液的稀釋原理計算出氫離子濃度,再計算出溶液的pH;
(9)pH=2的鹽酸加水稀釋到1000倍,先計算出稀釋后溶液中氫離子濃度,再計算出溶液的pH。
(1)該硫酸溶液中氫離子濃度為:c(H+)=2c(H2SO4)=2×0.005mol/L=0.01mol/L,
該硫酸溶液的pH為:pH=lg[c(H+)]=lg0.01=2,
故答案為:2;
(2)0.1mol.L1的CH3COOH溶液(已知CH3COOH的電離常數Ka=1.8×10-5),醋酸根離子和氫離子濃度相等,由于電離程度小,CH3COOH的濃度近似為0.1mol/L,所以c(H+)=![]() mol/L=1.34×103mol/L,所以pH=lg(1.34×103)≈2.9,
mol/L=1.34×103mol/L,所以pH=lg(1.34×103)≈2.9,
故答案為:2.9;
(3)0.1mol.L1的NH3H2O溶液,NH3H2O的電離度為α=1%,則該氨水溶液中氫氧根離子濃度為:0.1mol/L×1%=1×103mol/L,則該溶液的pH=11,
故答案為:11;
(4)將pH=8的NaOH溶液中氫氧根離子濃度為:1×106mol/L,pH=10的NaOH溶液中氫氧根離子濃度為:1×104mol/L,兩溶液等體積混合后溶液中氫氧根離子濃度為:![]() ×(1×106mol/L+1×104mol/L)≈5×105mol/L,混合液中氫離子濃度為:c(H+)=
×(1×106mol/L+1×104mol/L)≈5×105mol/L,混合液中氫離子濃度為:c(H+)=![]() =2×1010mol/L,則混合液的pH═lg[c(H+)]=10lg2=9.7,
=2×1010mol/L,則混合液的pH═lg[c(H+)]=10lg2=9.7,
故答案為:9.7;
(5)常溫下,將pH=5的鹽酸中氫離子濃度為:1×105mol/L,pH=9的NaOH溶液中氫氧根離子濃度為:1×105mol/L,以體積比11:9混合后鹽酸過量,溶液顯酸性,混合液中氫離子濃度為:c(H+)=![]() mol/L=1×106mol/L,混合液的pH=6,
mol/L=1×106mol/L,混合液的pH=6,
故答案為:pH=6;
(6)將pH=3的HCl中氫離子濃度為0.001mol/L,pH=3的H2SO4中氫離子濃度為0.001mol/L,等體積混合后,混合液中氫離子濃度仍然為0.001mol/L,溶液的pH=3,
故答案為:3;
(7)0.001molL1的NaOH溶液中氫離子濃度為:1×1011mol/L,該溶液的pH=11,
故答案為:11;
(8)pH=2的鹽酸中氫離子濃度為0.01mol/L,與等體積的水混合后氫離子濃度為0.005mol/L,混合液的pH=3lg5=3(1lg2)=2.3,
故答案為:2.3;
(9)pH=2的鹽酸中氫離子濃度為0.01mol/L,加水稀釋到1000倍后氫離子濃度為:1×105mol/L,該溶液的pH=5,
故答案為:5。


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】如圖分別表示冰晶體、干冰晶體、金剛石晶體的結構,下列關于這些晶體的說法正確的是
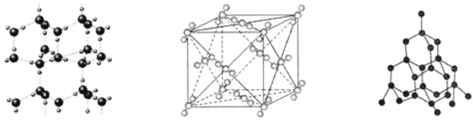
A.冰晶體中只存在范德華力和氫鍵兩種作用力
B.沸點:金剛石![]() 干冰
干冰![]() 冰
冰
C.冰晶體中的氧原子和金剛石中的碳原子均可形成四面體結構
D.干冰晶體中每個![]() 周圍距離相等且最近的
周圍距離相等且最近的![]() 有10個
有10個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氫氣、鋁、鐵都是重要的還原劑,已知下列反應的熱化學方程式,下列關于反應的焓變判斷正確的是
2H2(g)+O2(g)===2H2O(g) △H1
3H2(g)+Fe2O3(s)===2Fe (s)+ 3H2O(g) △H2
2Fe(s)+ 3/2O2(g)===Fe2O3(s) △H3
2Al(s)+3/2O2(g)===Al2O3(s) △H4
2Al(s)+ Fe2O3(s)===Al2O3(s)+2Fe(s) △H5
A. △H1<0;△H3>0 B. △H5<0;△H4<△H3
C. △H1=△H2+△H3 D. △H3=△H4+△H5
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知反應:2NO(g)+Br2(g)![]() 2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
2NOBr(g) △H=-a kJ·mol-1 (a>0),其反應機理如下
①NO(g)+Br2(g)![]() NOBr2(g) 快 ②NO(g)+NOBr2(g)
NOBr2(g) 快 ②NO(g)+NOBr2(g)![]() 2NOBr(g) 慢
2NOBr(g) 慢
下列有關該反應的說法正確的是( )
A. 該反應的速率主要取決于①的快慢
B. NOBr2是該反應的催化劑
C. 正反應的活化能比逆反應的活化能小a kJ·mol-1
D. 增大Br2(g)濃度能增大活化分子百分數, 加快反應速率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關熱化學方程式的敘述正確的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,則氫氣的燃燒熱△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,則△H1>△H2
C. 含20.0g NaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則稀醋酸和稀NaOH溶液反應的熱化學方程式為: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃燒熱是283.0 kJ/mol,則2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“ZEBRA”蓄電池的結構如圖所示,電極材料多孔Ni/NiCl2和金屬鈉之間由鈉離子導體制作的陶瓷管相隔。下列關于該電池的敘述錯誤的是( )

A.電池反應中有NaCl生成
B.電池的總反應是金屬鈉還原三價鋁離子
C.正極反應為:NiCl2+2e-=Ni+2Cl-
D.鈉離子通過鈉離子導體在兩電極間移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,向10mL0.1molL-1HX溶液中逐滴加入0.2molL-1YOH溶液,混合溶液的pH變化情況如圖所示(溫度和體積變化忽略不計)。則下列結論錯誤的是( )
A.HX為一元強酸,YOH為一元弱堿
B.M點水的電離程度大于N點水的電離程度
C.N點對應溶液中粒子濃度:c(YOH)>c(Y+)>c(X-)>c(OH-)>c(H+)
D.25℃pH=a時的YX溶液中水電離出的c(H+)=1.0×10-amol·L-1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究氨氧化物與懸浮在大氣中海鹽粒子的相互作用時,涉及如下反應:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
NaNO3(s)+ClNO(g) K1 ΔH1<0(Ⅰ)
2NO(g)+Cl2(g)![]() 2ClNO(g) K2 ΔH2<0(Ⅱ)
2ClNO(g) K2 ΔH2<0(Ⅱ)
(1)4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K=_______(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常數K=_______(用K1、K2表示)。
(2)為研究不同條件對反應(Ⅱ)的影響,在恒溫條件下,向2 L恒容密閉容器中加入0.2 mol NO和0.1 mol Cl2,10 min時反應(Ⅱ)達到平衡。測得10 min內v(ClNO)=7.5×10-3 mol·L-1·min-1,則平衡后n(Cl2)=________mol,NO的轉化率α1=________。其他條件保持不變,反應(Ⅱ)在恒壓條件下進行,平衡時NO的轉化率α2________α1(填“>”“<”或“=”),平衡常數K2______(填“增大”“減小”或“不變”)。若要使K2減小,可采取的措施是________。
(3)實驗室可用NaOH溶液吸收NO2,反應為2NO2+2NaOH===NaNO3+NaNO2+H2O。含0.2 mol NaOH的水溶液與0.2 mol NO2恰好完全反應得1 L溶液A,溶液B為0.1 mol·L-1的CH3COONa溶液,則兩溶液中c(NO![]() )、c(NO
)、c(NO![]() )和c(CH3COO-)由大到小的順序為______________________________。(已知HNO2電離常數Ka=7.1×10-4 mol·L-1,CH3COOH的電離常數Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
)和c(CH3COO-)由大到小的順序為______________________________。(已知HNO2電離常數Ka=7.1×10-4 mol·L-1,CH3COOH的電離常數Ka=1.7×10-5 mol·L-1)可使溶液A和溶液B的pH相等的方法是________。
a.向溶液A中加適量水 b.向溶液A中加適量NaOH
c.向溶液B中加適量水 d.向溶液B中加適量NaOH
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電解質的電導率越大,導電能力越強。用0.100mol·L-1的KOH溶液分別滴定體積均為20.00mL、濃度均為0.100molL-1的鹽酸和CH3COOH溶液。利用傳感器測得滴定過程中溶液的電導率如圖所示。下列說法正確的是( )

A. 曲線②代表滴定CH3COOH溶液的曲線
B. 在相同溫度下,P點水電離程度大于M點
C. M點溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N點溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com