
| 時間t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 總壓強p/100kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
| 消耗量 |
| 起始量 |
| P |
| P0 |
| 0.798mol |
| 1mol |
| P |
| P0 |


科目:高中化學 來源: 題型:
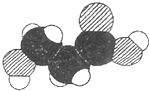
| A、分子中可能含有羥基 |
| B、分子中可能含有羧基 |
| C、該物質的分子式可能為C3H6O3 |
| D、分子中可能含有氨基 |
查看答案和解析>>
科目:高中化學 來源: 題型:
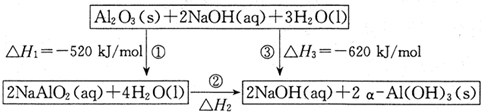
查看答案和解析>>
科目:高中化學 來源: 題型:
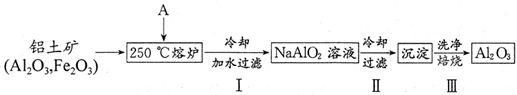
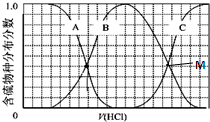 硫單質及其化合物在工農業生產中有著重要的應用.
硫單質及其化合物在工農業生產中有著重要的應用.查看答案和解析>>
科目:高中化學 來源: 題型:
| 實驗編號 | KClO3 | 氧化物 | 產生氣體(mL)(已折算為標況) | 耗時(s) | ||
| 化學式 | 質量(g) | 實際回收 | ||||
| 1 | 0.6 | - | - | - | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 6 7.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 異常 | 67.2 | 188.3 |
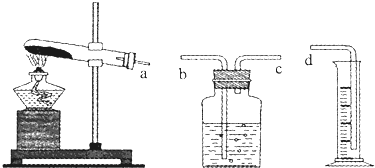
查看答案和解析>>
科目:高中化學 來源: 題型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
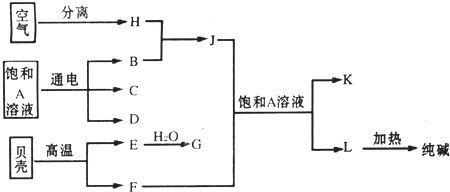

查看答案和解析>>
科目:高中化學 來源: 題型:
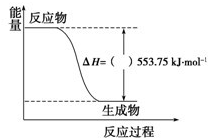 (1)許多運動會使用的火炬內熊熊大火來源于丙烷的燃燒,丙烷是一種優良的燃料.試回答下列問題:
(1)許多運動會使用的火炬內熊熊大火來源于丙烷的燃燒,丙烷是一種優良的燃料.試回答下列問題:| 鎂/800C/Ar |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com