
 氮及其化合物的轉化是資源利用和環境保護的重要研究課題,下面是氮的氧化物的幾種不同情況下的轉化.
氮及其化合物的轉化是資源利用和環境保護的重要研究課題,下面是氮的氧化物的幾種不同情況下的轉化.分析 (1)根據所給的條件反應,結合要求的目標反應,將條件反應調整計量數并做相應的加減得目標反應,反應熱做相應的變化即可;
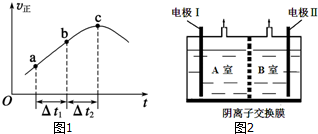
(2)①反應達平衡的根本標志是V正=V逆,而c點的只是V正最大而已;
②容器恒容絕熱,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反應放熱,若在該容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),則開始反應放熱;若在容器中加入II:1molSO3(g)和1mol NO(g),則開始時反應吸熱,據此分析平衡常數;
(3)通過A室產生了N2,可知A極的電解質溶液為NaNO3和NaNO2的混合溶液,NO2-在A極放電為N2,則A為陰極;則B極為陽極,電解質溶液為NaOH溶液,OH-在B極放電,據此分析;
(4)設出NO的體積為XL,NO2的體積為YL,則有X+Y=6 ①
然后根據和氨氣反應時得失電子數守恒可有:2X+4Y=7×3 ②
將兩式聯立即可解得.
解答 解:(1)已知:2SO2(g)+O2 (g)?2SO3 (g)△H=-196.6kJ•mol-1 ①
2NO(g)+O2 (g)?2NO2 (g)△H=-113.0kJ•mol-1 ②
將$\frac{①}{2}-\frac{②}{2}$可得:SO2(g)+NO2(g)?NO(g)+SO3 (g)△H=$\frac{-196.6KJ/mol}{2}$-$\frac{-113.0KJ/mol}{2}$=-41.6KJ/mol,而當反應熱△H<0時,反應放熱,
故答案為:放熱;
(2)①化學平衡狀態的標志是各物質的濃度不再改變,其實質是正反應速率等于逆反應速率,c點對應的正反應速率顯然還在改變,故一定未達平衡,
故答案為:未達;
②容器恒容絕熱,SO2(g)+NO2(g)?NO(g)+SO3 (g)△H<0,反應放熱,若在該容器中加入:Ⅰ:1molSO2(g)和1molNO2(g),則開始反應放熱,溫度升高平衡左移,K減小;若在容器中加入II:1molSO3(g)和1mol NO(g),則開始時反應吸熱,溫度降低平衡右移,K增大,故該反應的平衡常數Ⅰ<Ⅱ,
故答案為:<;
(3)通過A室產生了N2,可知I極的電解質溶液為NaNO3和NaNO2的混合溶液,NO2-在I放電為N2,則A為陰極;則II極為陽極,電解質溶液為NaOH溶液,OH-在II極放電.
①電極I為陰極,由于B室為NaOH溶液,且II極為陽極,故在II極放電的是氫氧根:4OH--4e-=O2↑+2H2O,即產生的氣體為氧氣,故答案為:陰極;O2;
②NO2-在陰極得電子被還原為氮氣,結合B室的溶液是中性溶液,故放電的方程式為:2NO2-+6e-+4H2O=8OH-+N2↑,故答案為:2NO2-+6e-+4H2O=8OH-+N2↑;
(4)設出NO的體積為XL,NO2的體積為YL,根據混合氣體的體積為6L,則有X+Y=6 ①
氨氣反應時,NO和NO2得電子,而氨氣失電子,根據得失電子數守恒可有:2X+4Y=7×3 ②
將兩式聯立即可解得X=1.5,Y=4.5,則有X:Y=1:3,故答案為:1:3.
點評 本題考查了蓋斯定律的應用、化學平衡常數的大小比較以及電化學知識的運用,綜合性較強,難度適中.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯和聚乙烯均能和溴水發生加成反應而使溴水褪色 | |
| B. | 二氧化氯和三氯化鐵都常用于自來水的處理,二者的作用原理相同 | |
| C. | Ksp不僅與難溶電解質的性質和溫度有關,而且還與溶液中的離子濃度有關 | |
| D. | 7.8g過氧化鈉含有的共用電子對數為0.1NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鋁片與氧化鐵混合加熱進行鋁熱反應 | |
| B. | 將蔗糖溶于水,加熱幾分鐘后再加人少量新制的Cu(OH)2就可實現將蔗糖水解,并用新制的Cu(OH)2檢驗蔗糖的水解產物 | |
| C. | 用溴的四氯化碳溶液就能鑒別乙烷與乙烯 | |
| D. | 向裂化汽油中加人酸性高錳酸鉀溶液,振蕩,紫色褪去說明汽油中含有甲苯等苯的同系物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
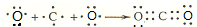 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
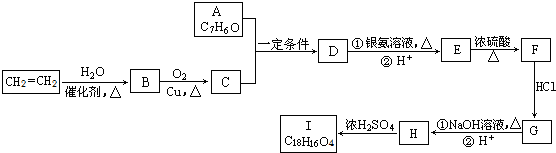
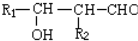
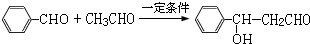 .
.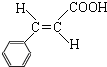 .
. .
.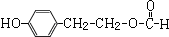
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

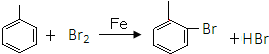 .
. .
.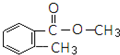 .
. 或
或  的鄰、間、對的任意一種.
的鄰、間、對的任意一種.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生石灰能與水反應,可用來干燥氯氣 | |
| B. | 氯化鋁是一種電解質,可用于電解法制鋁 | |
| C. | 液氨汽化時要吸收大量的熱,可用做制冷劑 | |
| D. | 二氧化硅不與強酸反應,可用石英器皿盛放氫氟酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 研究金屬鐵及其化合物的性質有重要意義.
研究金屬鐵及其化合物的性質有重要意義.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com