
| 實驗方案 | 實驗操作 | 實驗現象 | 結論 |
| 方案1 | 取少量白色物質于試管中,加入適量水,振蕩,樣品全部溶于水,向其中加入無色酚酞試液 | 溶液變成紅色 | 白色物質是Na2O. |
| 方案2 | ①取少量白色物質于試管中,加入適量水,振蕩,樣品全部溶于水,向其中加入適量BaCl2 | 有白色沉淀生成 | 白色物質是Na2CO3 |
| ②靜置片刻,取上層清液于試管中… | …. |
分析 假設3:白色物質還可能是二者的混合物;
(1)碳酸鈉是強堿弱酸鹽,碳酸根離子水解導致其溶液呈堿性,無色酚酞試液遇堿溶液變紅色;
(2)氯化鋇和碳酸鈉反應生成白色碳酸鋇沉淀同時生成NaCl,NaCl溶液呈中性,酚酞試液在中性溶液中呈無色;
(3)任何化學反應中都遵循質量守恒定律,即存在元素守恒、各元素的原子個數守恒;
(4)鈉和二氧化碳在點燃條件下反應生成碳酸鈉和C,根據反應物、生成物及反應條件書寫方程式.
解答 解:氧化鈉和碳酸鈉都是白色固體,所以白色物質可能是Na2O和Na2CO3的混合物,故答案為:白色物質可能是Na2O和Na2CO3的混合物;
(1)碳酸鈉是強堿弱酸鹽,CO32-水解導致其溶液中c(OH-)>c(H+),則溶液呈堿性,無色酚酞試液遇堿溶液變紅色,所以如果滴加酚酞后溶液呈紅色,不能說明白色固體是氧化鈉,
故答案為:Na2CO3的水溶液顯堿性,遇酚酞變紅色;
(2)氯化鋇和碳酸鈉反應生成白色碳酸鋇沉淀同時生成NaCl,NaCl是強酸強堿鹽,鈉離子和氯離子都不水解,導致其溶液呈中性,酚酞試液在中性溶液中呈無色,所以實驗操作是滴加酚酞試液,看到的現象是溶液顏色無變化,就說明白色固體是碳酸鈉,
故答案為:滴加酚酞試液;溶液顏色沒有變化(上層清液是NaCl顯中性);
(3)任何化學反應中都遵循質量守恒定律,即存在元素守恒、各元素的原子個數守恒,反應物中沒有H元素,所以不能生成NaOH,故答案為:不同意;反應物中無氫元素,違背質量守恒定律;
(4)在點燃條件下,鈉和二氧化碳反應生成碳酸鈉和C,反應方程式為4Na+3CO2$\frac{\underline{\;點燃\;}}{\;}$2Na2CO3+C,故答案為:4Na+3CO2$\frac{\underline{\;點燃\;}}{\;}$2Na2CO3+C.
點評 本題考查探究物質的組成,涉及物質成分判斷、離子檢驗、鹽類水解、質量守恒定律等知識點,明確物質的性質及實驗原理是解本題關鍵,可以類比鎂和二氧化碳的反應結合假設2書寫方程式,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 該電池的負極反應方程式為Zn-2e-+3OH-=HZnO2-+H2O | |
| B. | 當負極減重65g時,正極消耗O2的體積為11.2L | |
| C. | 電池在放電過程中陽離子移向負極,陰離子移向正極 | |
| D. | 隨著放電過程進行,電池正極區域附近pH減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
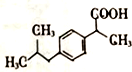

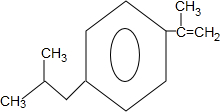 +H2O$→_{△}^{催化劑}$
+H2O$→_{△}^{催化劑}$ .
.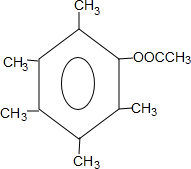 或
或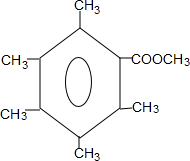 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 濃硫酸與少量銅片反應的實驗,下列是對實驗操作、實驗現象或解釋等的有關記錄,其中與事實不符或解釋不合理的是( )
濃硫酸與少量銅片反應的實驗,下列是對實驗操作、實驗現象或解釋等的有關記錄,其中與事實不符或解釋不合理的是( )| A. | 實驗開始時需給a試管稍微加熱 | |
| B. | 反應開始時銅片表面可以看到有黑色物質生成 | |
| C. | 將a試管里的溶液冷卻后注入盛有水的燒杯中,溶液呈藍色 | |
| D. | b試管中的溶液逐漸褪為無色,說明反應生成的氣體,將品紅氧化為無色 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
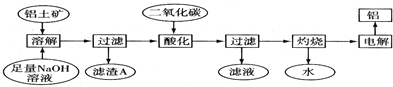
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反應在0~3 s內的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他條件不變,降低溫度,達到新平衡時測得c(O2)=0.44 mol•L-1,則反應的△H<0 | |
| C. | 在T溫度下,起始時向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反應達到平衡時,壓強為起始時的0.88倍 | |
| D. | 在T溫度下,起始時向容器中充入2.0 mol N2O5和2.0 mol O2,達到平衡時,N2O5的轉化率大于20% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
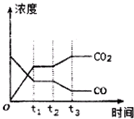 節能減排是當下環境保護的重點.
節能減排是當下環境保護的重點.| H2O | CO | CO2 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器編號 | c(CO)/mol•L-1 | c(O2))/mol•L-1 | c(CO2))/mol•L-1 | v(正)和v(逆)比較 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | v(正)=v(逆) |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | v(正)>v(逆) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 若R(OH)n為強堿,則W(OH)n+1也為強堿 | |
| B. | 若最高氧化物的水化物HnXOm為強酸,則Y是活潑非金屬元素 | |
| C. | 若Y的最低化合價為-2,則Z的最高正化合價為+6 | |
| D. | 若X的最高正化合價為+5,則五種元素都是非金屬元素 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com