
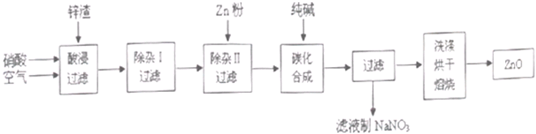
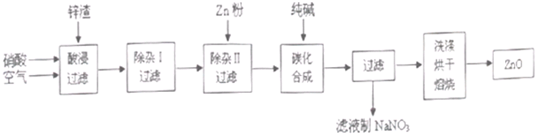
現從鋅制品加工企業回收的廢渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等雜質)來制取氧化鋅,流程如下:

有關氫氧化物完全沉淀的pH見下表:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
|
pH |
5.2 |
3.2 |
9.7 |
6.7 |
8.0 |
(l)在酸浸過程中,要提高鋅元素的浸出率,可以采取 措施。
(2)上述流程中多處涉及“過濾”,實驗室中過濾操作需要使用的玻璃儀器有 。
(3)在“除雜I”步驟中,將溶液調至pH=4的目的是 。在“除雜II”后,溶液的pH約為6,則此步過濾時濾渣中含有 。
(4)在“碳化合成”中,生成的產物之一為堿式碳酸鋅[Zn2(OH)2CO3],同時放出CO2,請寫出該反應的化學方程式 。
(5)從濾液中提取NaNO3晶體的操作步驟為 。
(6)在實驗室如何洗滌過濾出的堿式碳酸鋅? 。
(16分)
(1)加熱、攪拌(2分)
(2)燒杯、玻璃棒、漏斗 (3分)
(3)使Fe3+轉化為Fe(OH)3沉淀除去(2分)
Al(OH)3、Cu、Zn (2分) (不填Zn不扣分)
(4)2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑(2分)
(5)蒸發濃縮、冷卻結晶、過濾(3分)
(6)往漏斗中加入少量蒸餾水,浸沒沉淀,讓其自然濾出,反復幾次(2分)
【解析】
試題分析:(1)增大反應物濃度、升高溫度、增大壓強(有氣體參加的反應)、增大固體表面積、使用合適的催化劑、研磨、攪拌、振蕩等措施,都是加快反應速率、提高浸出率的常用措施;(2)過濾分離固液混合物,常用的玻璃儀器有燒杯、普通漏斗、玻璃棒;(3)硝酸具有強氧化性和強酸性,酸性條件下空氣中的氧氣也能將亞鐵離子氧化為鐵離子,則溶液中含有Zn2+、Fe3+、Cu2+、Al3+、H+、NO3-,讀表中信息可知,將溶液pH調至4時,鐵離子完全變為氫氧化鐵沉淀,可以除去溶液中的鐵離子;將溶液pH調至6時,鋁離子完全變為氫氧化鋁沉淀,可以除去溶液中的鋁離子,由于鋅比銅活潑,則加入過量的鋅不僅能消耗氫離子,而且能將銅離子完全還原為單質銅,既除去雜質,又沒有引入新雜質,則除雜II所得濾渣主要成分為氫氧化鋁、銅、鋅;(4)依題意,加入的碳酸鈉與硝酸鋅溶液反應,生成堿式碳酸、二氧化碳,根據質量守恒原理可得該復分解反應方程式:2Na2CO3+2Zn(NO3)2+H2O=4NaNO3+Zn2(OH)2CO3+CO2↑;(5)硝酸鈉是可溶性鹽,溶解度隨溫度下降而明顯減小,根據其性質推斷,將濾液蒸發濃縮、冷卻結晶、過濾得到硝酸鈉晶體;(6)根據過濾之后洗滌沉淀的一般原理,洗滌堿式碳酸鋅時,先向漏斗中加入少量蒸餾水,浸沒沉淀,再讓其自然濾出,反復幾次即可。
考點:考查有關物質制備的化學工藝流程,涉及加快反應速率的措施、過濾、解釋溶液pH控制到一定值的目的、濾渣成分、關鍵步驟的化學反應方程式、提取晶體的方法、沉淀的洗滌等。


科目:高中化學 來源: 題型:
| 沉淀物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化學 來源:珠海一模 題型:問答題

| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化學 來源:2013年廣東省珠海市高考化學一模試卷(解析版) 題型:解答題

| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com