

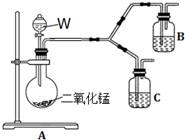
分析 (1)由儀器結構特征,可知A為蒸餾燒瓶;
由題目信息可知,硫代硫酸鈉易溶于水、難溶于乙醇,應用乙醇洗滌,減少因溶解導致損失;
(2)Na2S2O3在酸性條件下會反應生成S和二氧化硫;
(3)三頸燒瓶中SO2與Na2S、Na2CO3反應生成Na2S2O3,同時生成二氧化碳;
(4)加入鹽酸,Na2S2O3反應生成S沉淀,靜置后取上層清液,滴加BaCl2溶液,檢驗溶液中是否含有硫酸根離子;
(5)根據圖示的滴定管中液面讀出初讀數、終讀數,然后計算出消耗碘的標準溶液體積,根據反應2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),然后碘單質的物質的量計算出Na2S2O3•5H2O質量及產品的純度;
(6)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,反應生成硫酸鈉、氯化鈉,配平書寫離子方程式.
解答 解:(1)由儀器結構特征,可知A為蒸餾燒瓶;由題目信息可知,硫代硫酸鈉易溶于水、難溶于乙醇,應用乙醇洗滌,減少因溶解導致損失,
故答案為:蒸餾燒瓶;乙醇;
(2)Na2S2O3在酸性條件下會生成S和二氧化硫,產率會下降,其反應的離子方程式為:S2O32-+2H+=S↓+H2O+SO2↑;
故答案為:S2O32-+2H+=S↓+H2O+SO2↑;
(3)三頸燒瓶中SO2與Na2S、Na2CO3反應生成Na2S2O3,同時生成二氧化碳,反應總方程式為:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2,
故答案為:4SO2+2Na2S+Na2CO3=3Na2S2O3+CO2;
(4)檢測產品中是否存在Na2SO4的實驗方案為:取少量產品溶于足量稀鹽酸、靜置、取上層清液(或過濾,取濾液)、滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質,
故答案為:取少量產品溶于足量稀鹽酸、靜置、取上層清液(或過濾,取濾液)、滴加BaCl2溶液,若出現沉淀則說明含有Na2SO4雜質;
(5)根據圖示的滴定管中液面可知,滴定管中初始讀數為2.50mL,滴定終點液面讀數為18.50mL,所以消耗碘的標準溶液體積為18.50mL-2.50mL=16.00mL;
根據反應2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以1.00 g產品中含有Na2S2O3•5H2O質量為:0.1000 mol•L-1×16.00×10-3L×2×248g/mol=0.7936g,故則產品的純度為:$\frac{0.7936g}{1.00g}$×100%=79.36%,
故答案為:16.00;79.36;
(6)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,配平后的離子方程式為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
點評 本題考查實驗方案方案,涉及儀器識別、對操作的分析評價、方程式書寫、離子檢驗、化學計算等,側重實驗分析能力及知識綜合應用能力的考查,題目難度中等.


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:選擇題
| A. | 限制使用電動車 | |
| B. | 利用太陽能、風能和氫能等能源代替化石燃料 | |
| C. | 鼓勵私人購買和使用汽車代替公交車 | |
| D. | 以煤等燃料作為主要生活燃料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 元素及其化合物的學習和應用是中學化學的主要任務之一.
元素及其化合物的學習和應用是中學化學的主要任務之一.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分子總數為NA的NO2和CO2的混合氣體中含有的氧原子數是2NA | |
| B. | 28g乙烯和環丁烷(C4H8)的混合氣體中含有的碳原子數為2NA | |
| C. | 常溫常壓下,92g的NO2和N2O4混合氣體含有的原子數為6NA | |
| D. | 常溫常壓下,22.4L氯氣與足量鎂粉充分反應后,轉移的電子數為2NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 下表是某學生為探究AgCl沉淀轉化為Ag2S沉淀的反應所做實驗的記錄.
下表是某學生為探究AgCl沉淀轉化為Ag2S沉淀的反應所做實驗的記錄.| 步 驟 | 現 象 |
| Ⅰ.取5mL 0.1mol/L AgNO3與一定體積0.1mol/L NaCl溶液,混合,振蕩. | 立即產生白色沉淀 |
| Ⅱ.向所得懸濁液中加入2.5mL 0.1mol/L Na2S溶液. | 沉淀迅速變為黑色 |
| Ⅲ.將上述黑色濁液,放置在空氣中,不斷攪拌. | 較長時間后,沉淀變為乳白色 |
| Ⅳ.濾出Ⅲ中的乳白色沉淀,加入足量HNO3溶液. | 產生紅棕色氣體,沉淀部分溶解 |
| Ⅴ.過濾得到濾液X和白色沉淀Y;向X中滴加Ba(NO3)2溶液. | 產生白色沉淀 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化肥名稱 | 尿素 | 碳酸氫銨 | 硫酸銨 | 氨水 |
| 溶液的pH | 7 | 8 | 5 | 11 |
| A. | 碳酸氫銨 | B. | 尿素 | C. | 氨水 | D. | 硫酸銨 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
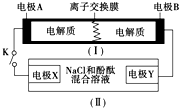 下圖為一種可充電電池的示意圖,其中的離子交換膜只允許K+通過,該電池放電、充電的化學反應方程式為:2K2S2+KI3 $?_{充電}^{放電}$K2S4+3KI.裝置(Ⅱ)為電解池的示意圖.當閉合開關K時,電極X附近溶液先變紅.則閉合K時,下列說法正確的是( )
下圖為一種可充電電池的示意圖,其中的離子交換膜只允許K+通過,該電池放電、充電的化學反應方程式為:2K2S2+KI3 $?_{充電}^{放電}$K2S4+3KI.裝置(Ⅱ)為電解池的示意圖.當閉合開關K時,電極X附近溶液先變紅.則閉合K時,下列說法正確的是( )| A. | K+從左到右通過離子交換膜 | |
| B. | 電極A上發生的反應為:3I--2e-═I3- | |
| C. | 電極X上發生的反應為:2Cl--2e-═Cl2↑ | |
| D. | 當有0.1 mol K+通過離子交換膜,X電極上產生1.12 L氣體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com