
(16分)
(1)合成氨反應反應N2(g)+3H2(g)2NH3(g),若在恒溫、恒壓條件下向平衡體系中通入氬氣,平衡 移動(填“向左”“向右”或“不”);使用催化劑 反應的ΔH(填“增大”“減小”或“不改變”)。
(2)已知:N2H4(g)+O2(g)=N2(g)+2H2O(g);△H=-543kJ·mol-1
H2(g)+
F2(g)=HF(g);△H=-269kJ·mol-1
H2(g)+O2(g)=H2O(g);△H=-242kJ·mol-1
則反應 N2H4(g)+2F2(g)=N2(g)+4HF(g) 的H=_____________ kJ·mol-1。
(3)已知25℃時Ksp[Mg(OH)2]=1.8×10-11,KsP[Cu(OH)2]=2.2×10-20。在25℃下,向濃度均為0.1 mol·L-1的MgCL2和CuCl2混合溶液中逐滴加入氨水,先生成__________沉淀(填化學式),生成該沉淀的離子方程式為______。
(4)在25℃下,將a mol·L-1的氨水與0.01 mol·L-1的鹽酸等體積混合,反應平衡時溶液中c(NH4+)=c(Cl-),則溶液顯_____________性(填“酸”“堿”或“中”);用含a的代數式表示此時溶液中NH3·H2O的物質的量濃度__________ mol·L-1。(說明:溶液的體積可以直接相加)
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源: 題型:
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
| c2(NH3)平衡 |
| c(N2)平衡c3(H2)平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:

| A、該反應為自發反應,由圖1可得加入適當的催化劑,E和△H都減小 | B、圖2中0~10min內該反應的平均速率v(H2)=0.045mol?L-1?min-1,從11min起其它條件不變,壓縮容器的體積為1L,則n(N2)的變化曲線為d | C、圖3中a、b、c三點所處的平衡狀態中,反應物N2的轉化率最高的是b點 | D、圖3中T1和T2表示溫度,對應溫度下的平衡常數為K1、K2,則:T1>T2,K1>K2 |
查看答案和解析>>
科目:高中化學 來源: 題型:
(16分)氨氣是一種重要的基礎化工原料,用途廣泛。
在微電子工業中,氨水可作刻蝕劑H2O2 的清除劑,產物不污染環境。該反應的化學方程式為2NH3+3H2O2= +6H2O
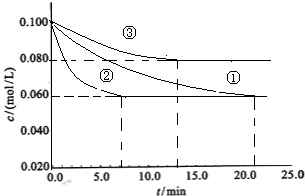
工業中常用以下反應合成氨:N2+3H22NH3 △H<0。某實驗室在三個不同條件的密閉容器中,分別加入濃度均為C(N2)=0.100mol/L,C(H2)=0.300mol/L進行反應時, N2的濃度隨時間的變化如下圖①、②、③曲線所示。
(1)該反應平衡常數的數學表達式 ;實驗②平衡時H2的轉化率為_______
(2)據圖所示,②、③兩裝置中各有一個條件與①不同。請指出,并說明判斷的理由。
②條件:_______ 理由: ________
③條件:_______ 理由: ________
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省五校高三第一次聯考化學試卷 題型:選擇題
合成氨反應為:N2(g)+3H2(g)  2NH3(g)。圖1表示在一定的溫度下此反應過程中的能量的變化,圖2表示在2L的密閉容器中反應時N2的物質的量隨時間的變化曲線。圖3表示在其他條件不變的情況下,改變起始物氫氣的物質的量對此反應平衡的影響。
2NH3(g)。圖1表示在一定的溫度下此反應過程中的能量的變化,圖2表示在2L的密閉容器中反應時N2的物質的量隨時間的變化曲線。圖3表示在其他條件不變的情況下,改變起始物氫氣的物質的量對此反應平衡的影響。

下列說法正確的是:
A.該反應為自發反應,由圖1可得加入適當的催化劑,E和△H都減小
B.圖2中0~10min內該反應的平均速率v(H2)=0.045mol·L-1·min-1,從11min起其
它條件不變,壓縮容器的體積為1L,則n(N2)的變化曲線為d
C.圖3中a、b、c三點所處的平衡狀態中,反應物N2的轉化率最高的是b點
D.圖3中T1和T2表示溫度,對應溫度下的平衡常數為K1、K2,則:T1>T2,K1>K2
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com