
已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。以下四個化學反應方程式:
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l);
②H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l);
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l);
④CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l),其中反應熱為57.3 kJ·mol-1的是( )
A.①和② B.③
C.④ D.以上都不對
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
 (2012?淄博一模)硫及其化合物在國民生產中占有重要的地位.
(2012?淄博一模)硫及其化合物在國民生產中占有重要的地位.| 1 | 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (K) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
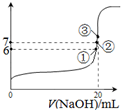 ,下列說法正確的是
,下列說法正確的是 SO2Cl2(l)△H=-97.3kJ?mol-1
SO2Cl2(l)△H=-97.3kJ?mol-1查看答案和解析>>
科目:高中化學 來源: 題型:
| 化學式 | HF | H2CO3 | HClO |
| 電離平衡常數 (Ka) |
7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 |
3.0×10-8 |
| c(H+) |
| c(HF) |
| c(OH-) |
| c(H+) |
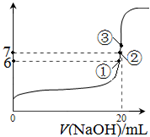
查看答案和解析>>
科目:高中化學 來源: 題型:
強酸和強堿的稀溶液的中和熱可表示為:w.w.w.k.s.5 u.c.o.m
H+(aq)+OH-(aq)=H2O(1) △H =-57.3kJ/mol
已知:
CH3COOH(aq)+NaOH(aq)=CH3COONa(aq)+H2O △H = -Q1kJ/mol
1/2H2SO4(濃) + NaOH(aq) =1/2Na2SO4(aq) +H2O(1) △H = -Q2kJ/mol
HNO3(aq)+KOH(aq)=KNO3(aq)+H2O(1) △H = -Q3kJ/mol
上述反應均為溶液中的反應,則Q1、Q2、Q3的絕對值大小的關系為
A.Q1=Q2=Q3 B.Q2>Q1>Q3 C.Q2>Q3>Q1 D.Q2=Q3>Q1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com