
分析 A、B、C、D是原子序數依次增大的四種短周期元素,A、D同主族且能形成兩種不同化合物,則A為O、D為S元素;
B、C同周期,A、B、C的簡單離子具有相同的核外電子排布,B、C的最高價氧化物對應的水化物可以生成鹽和水,則B最高價氧化物的水化物是強堿溶液、C的最高價氧化物的水化物呈兩性,所以B為Na、C是Al元素,
(1)C、D形成的氧化物分別是氧化鋁、二氧化硫或三氧化硫,氧化鋁中含有離子鍵、硫的氧化物屬于分子晶體;
(2)離子電子層數越多其離子半徑越大,電子層結構相同的離子半徑隨著原子序數增大而減小;
(3)B、C的最高價氧化物的水化物分別是NaOH、Al(OH)3,NaOH溶液和Al(OH)3反應生成偏鋁酸鈉和水.
解答 解:A、B、C、D是原子序數依次增大的四種短周期元素,A、D同主族且能形成兩種不同化合物,則A為O、D為S元素;
B、C同周期,A、B、C的簡單離子具有相同的核外電子排布,B、C的最高價氧化物對應的水化物可以生成鹽和水,則B最高價氧化物的水化物是強堿溶液、C的最高價氧化物的水化物呈兩性,所以B為Na、C是Al元素,
(1)C、D形成的氧化物分別是氧化鋁、二氧化硫或三氧化硫,氧化鋁中含有離子鍵、硫的氧化物屬于分子晶體,熔融氧化鋁需要破壞離子鍵、硫的氧化物需要破壞的是分子間作用力,離子鍵比分子間作用力強得多,所以氧化鋁的熔點較高,
故答案為:Al2O3;氧化鋁融化需要破壞離子鍵,而硫的氧化物需要破壞的是分子間作用力,離子鍵比分子間作用力強得多;
(2)離子電子層數越多其離子半徑越大,電子層結構相同的離子半徑隨著原子序數增大而減小,所以質量半徑大小順序是S2-、O2-、Na+、Al3+,故答案為:S2-、O2-、Na+、Al3+;
(3)B、C的最高價氧化物的水化物分別是NaOH、Al(OH)3,NaOH溶液和Al(OH)3反應生成偏鋁酸鈉和水,反應方程式為Al(OH)3+NaOH=NaAlO2+2H2O,故答案為:Al(OH)3+NaOH=NaAlO2+2H2O.
點評 本題考查原子結構和元素周期律,為高頻考點,明確原子結構、元素周期表結構、元素周期律是解本題關鍵,注意離子半徑比較方法及氫氧化鋁的兩性,為易錯點.


 狀元坊全程突破導練測系列答案
狀元坊全程突破導練測系列答案 直通貴州名校周測月考直通名校系列答案
直通貴州名校周測月考直通名校系列答案科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表中短周期都是主族元素 | |
| B. | 原子核外在離核較遠區域的電子易失去,其原因是這些電子的能量較高 | |
| C. | 通過化學變化可以實現16O與18O間的相互轉化 | |
| D. | 對于吸收能量的反應必需加熱才能發生 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 穩定性:A2D<A2X | |
| B. | CA3分子的立體結構為平面三角形 | |
| C. | C形成的單質中σ鍵與π鍵個數之比為1:2 | |
| D. | B、C、D形成的氣態氫化物互為等電子體 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
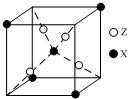 元素X位于第四周期,其基態原子有4個未成對電子.Y原子最外層電子數是其內層電子總數的3倍,元素Z基態原子的3p軌道上有4個電子.
元素X位于第四周期,其基態原子有4個未成對電子.Y原子最外層電子數是其內層電子總數的3倍,元素Z基態原子的3p軌道上有4個電子.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 16.32.48.64 | B. | 16.17.18.19 | C. | 16.30.44.58 | D. | 16.28.40.52 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素丙的單質可用于冶煉金屬 | B. | 甲與丁形成的分子是酸性氧化物 | ||
| C. | 簡單離子半徑:丁>乙>丙 | D. | 甲與乙形成的化合物均有強氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
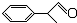 )曾入選倫敦奧運會指定產品,下面是工業合成龍葵醛的路線圖(部分反應條件及副產物已略去),回答問題:
)曾入選倫敦奧運會指定產品,下面是工業合成龍葵醛的路線圖(部分反應條件及副產物已略去),回答問題: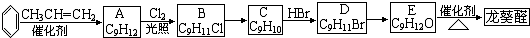
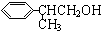 +O2
+O2
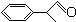 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加熱,用濕潤的紅色石蕊試紙置于試管口檢驗 | |
| B. | 加強堿溶液后加熱,再滴入無色酚酞試液 | |
| C. | 加熱,用蘸有濃鹽酸的玻璃棒置于試管口檢驗 | |
| D. | 加燒堿溶液后加熱,再用濕潤的紅色石蕊試紙置于試管口檢驗 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com