
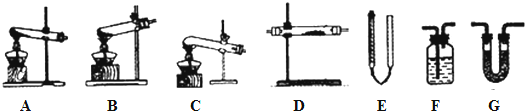
分析 (1)草酸晶體的熔點低,受熱容易熔化,用C裝置加熱分解革酸晶體,熔融的固體不易流下,適用于加熱草酸,若選擇裝置A加熱會使固體熔融物溶化后流到試管口處,若選擇裝置B分解生成的水會倒流試管底部炸裂試管;
(2)150℃左右分解產生H2O、CO和C02,三種氣體的檢驗順序應遵循現象明顯且不相互干擾,應先檢驗水,再檢驗二氧化碳,最后檢驗一氧化碳;
(3)實驗利用裝置“G(堿石灰)-F-D(CuO固體)-F”檢驗CO,通過裝置G吸收水和二氧化碳,通過裝置F檢驗二氧化碳是否除凈,通過裝置D檢驗是否有一氧化碳含有氧化銅為銅,最后通過裝置F檢驗是否生成二氧化碳氣體;
(4)草酸晶體( H2C204•2H20)l00℃開始失水,101.5C熔化,150℃左右分解產生H2O、CO和C02.反應的化學方程式為:H2C204•2H20$\frac{\underline{\;\;△\;\;}}{\;}$3H2O+CO+C02,實驗得到氣體的體積為V mL(已換算成標準狀況),為一氧化碳,物質的量和草酸晶體物質的量相同,據此計算;
(5)常溫時,用pH計測量0.100 mol/L 草酸鈉溶液的pH,依據水解平衡C2O42-+H2O?HC2O4-+OH-,計算平衡常數Kh=$\frac{c(O{H}^{-})•c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$=$\frac{{K}_{w}}{{K}_{a2}}$.
解答 解:(1)最適宜加熱分解革酸晶體的裝置是C.若選裝置A可能會造成的后果是固體藥品熔化后會流到試管口,若選裝置B可能會造成的后果是冷凝水會倒流到試管底,造成試管破裂,
故答案為:固體藥品熔化后會流到試管口;冷凝水會倒流到試管底,造成試管破裂;
(2)150℃左右分解產生H2O、CO和C02,三種氣體的檢驗順序應遵循現象明顯且不相互干擾,應先檢驗水,再檢驗二氧化碳,最后檢驗一氧化碳;
故答案為:C;
(3)實驗利用裝置“G(堿石灰)-F-D(CuO固體)-F”檢驗CO,通過裝置G吸收水和二氧化碳,通過裝置F檢驗二氧化碳是否除凈,通過裝置D檢驗是否有一氧化碳含有氧化銅為銅,最后通過裝置F檢驗是否生成二氧化碳氣體,
故答案為:澄清的石灰水;前一個F中沒有渾濁,后一個F中有沉淀,D中固體反應后從黑色變成紅色;
(4)反應的化學方程式為:H2C204•2H20$\frac{\underline{\;\;△\;\;}}{\;}$3H2O+CO+C02,實驗得到氣體的體積為V mL(已換算成標準狀況),為一氧化碳,物質的量和草酸晶體物質的量相同,n(H2C204•2H20)=n(CO)=$\frac{V×1{0}^{-3}}{22.4}$mol/L,
草酸純度的表達式═$\frac{\frac{V×1{0}^{-3}}{22.4}mol×126g/mol}{ag}$=$\frac{126×V×1{0}^{-3}}{22.4a}$,
故答案為:$\frac{126×V×1{0}^{-3}}{22.4a}$;
(5)常溫時,用pH計測量0.100 mol/L 草酸鈉溶液的pH,則c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;依據 C2O42-+H2O?HC2O4-+OH,Kh=$\frac{c(O{H}^{-})•c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$=$\frac{c(O{H}^{-})•c(H{C}_{2}{{O}_{4}}^{-})}{c({C}_{2}{{O}_{4}}^{2-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{a2}}$,則依據C2O42-+H2O?HC2O4-+OH-計算$\frac{{K}_{w}}{{K}_{a2}}$=$\frac{{c}^{2}(O{H}^{-})}{0.1-c(O{H}^{-})}$,Ka2=$\frac{0.1-c(O{H}^{-})}{{c}^{2}(O{H}^{-})}×{K}_{w}$,
故答案為:常溫時,用pH計測量0.100 mol/L 草酸鈉溶液的pH,則c(OH-)=$\frac{{K}_{w}}{c({H}^{+})}$;依據C2O42-+H2O?HC2O4-+OH計算$\frac{{K}_{w}}{{K}_{a2}}$=$\frac{{c}^{2}(O{H}^{-})}{0.1-c(O{H}^{-})}$,Ka2=$\frac{0.1-c(O{H}^{-})}{{c}^{2}(O{H}^{-})}×{K}_{w}$.
點評 本題考查了物質在的探究實驗過程分析判斷,題目難度中等,主要是物質檢驗、物質含量的測定方法分析應用,掌握基礎是解題關鍵,試題培養了學生的分析能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | 鎂與稀鹽酸反應 | B. | CO燃燒生成CO2 | ||
| C. | 氫氧化鋇晶體與氯化銨晶體反應 | D. | 生石灰溶于水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 一定溫度下,10mL 0.50mol•L-1NH4Cl溶液與20mL 0.25mol•L-1NH4C1溶液含NH4+物質的量相同 | |
| B. | 25℃時,將a mo1•L-l氨水與0.01 moI•L-1鹽酸等體積混合,反應完全時溶液中c(NH4+)=c(C1-),用含a的代數式表示反應完全時NH3•H2O的電離常數Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 一定溫度下,已知0.1 mol•L-1 的醋酸溶液中存在電離平衡:CH3COOH?CH3COO-+H+,加少量燒堿溶液可使溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$值增大 | |
| D. | 等體積、pH都為3的酸HA和HB分別與足量的鋅反應,HA放出的氫氣多,說明酸性:HA>HB |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

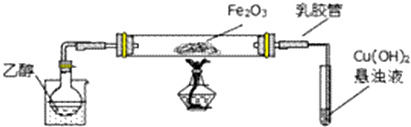
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
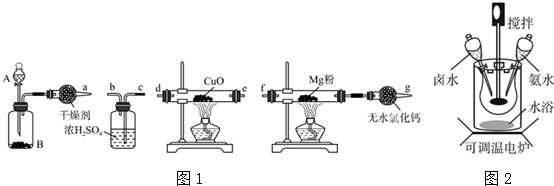
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
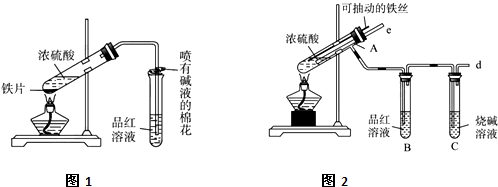
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
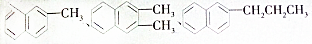 都屬于萘(結構簡式:
都屬于萘(結構簡式: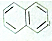 的同系物,則萘和萘的同系物分子組成通式是( )
的同系物,則萘和萘的同系物分子組成通式是( )| A. | CnH2n-6(n≥11) | B. | CnH2n-12(n>10) | C. | CnH2n-10(n≥10) | D. | CnH2n-12(n≥10) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究性學習小組為了證明在同溫同壓下,相同濃度相同體積的酸性不同的一元酸與足量鎂帶反應時,生成氫氣的體積相同而反應速率不同,同時測定實驗室條件下的氣體摩爾體積.設計的簡易實驗裝置如圖所示.該實驗的主要操作步驟如下:
某研究性學習小組為了證明在同溫同壓下,相同濃度相同體積的酸性不同的一元酸與足量鎂帶反應時,生成氫氣的體積相同而反應速率不同,同時測定實驗室條件下的氣體摩爾體積.設計的簡易實驗裝置如圖所示.該實驗的主要操作步驟如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com