
 已知反應:2NO2(g)?N2O4(g),△H<0,為了探究溫度對化學平衡的影響,有人做了如圖實驗:把NO2和N2O4的混合氣體通入甲、乙兩個連通的燒瓶里,然后用夾子夾住橡皮管,把兩燒瓶分別浸入兩個分別盛有500mL 6mol/L的HCl溶液和盛有500mL蒸餾水的燒杯中(兩燒杯中溶液的溫度相同).
已知反應:2NO2(g)?N2O4(g),△H<0,為了探究溫度對化學平衡的影響,有人做了如圖實驗:把NO2和N2O4的混合氣體通入甲、乙兩個連通的燒瓶里,然后用夾子夾住橡皮管,把兩燒瓶分別浸入兩個分別盛有500mL 6mol/L的HCl溶液和盛有500mL蒸餾水的燒杯中(兩燒杯中溶液的溫度相同).分析 (1)試驗中用兩個經導管連通的燒瓶,可以使兩個燒瓶的起始狀態完全相同,起到對照作用;
(2)根據溫度對化學平衡的影響分析,氫氧化鈉溶解和鹽酸中和反應都使溶液溫度升高,硝酸銨溶解溶液溫度降低,2NO2(g)?N2O4(g)△H<0,依據化學平衡移動原理分析,升溫平衡向吸熱方向進行,降溫平衡向放熱反應方向進行,二氧化氮是紅棕色氣體,四氧化二氮是無色氣體;
(3)根據溫度對可逆反應的影響進行分析;
(4)該反應中有氣體參與,溫度改變后氣體體積也改變,壓強也會影響化學平衡.
解答 解:(1)該實驗用兩個經導管連通的燒瓶,確兩個個燒瓶中可逆反應的起始平衡狀態完全相同,便于對比,
故答案為:使兩個燒瓶中可逆反應的起始平衡狀態完全相同,便于對比;
(2)因NaOH溶于水以及與NaOH與HCl的反應都是放熱反應,所以燒杯甲的溶液的溫度升高,溫度升高,平衡2NO2(g)?N2O4(g)△H<0向吸熱方向移動,即逆反應方向移動,NO2濃度增大,顏色加深;
因NH4NO3溶于水是吸熱的,使體系溫度降低,使平衡2NO2(g)?N2O4(g)△H<0向放熱熱方向移動,即反應方向移動,NO2濃度減小,顏色變淺,
故答案為:變深;NaOH溶解放熱,中和HCl也放熱,使甲瓶氣體溫度升高,平衡逆向移動,c(NO2)增大;變淺;NH4NO3溶解吸熱,乙燒瓶氣體的溫度降低,平衡2NO2,N2O4向正反應方向移動,使NO2的濃度減小;
(3)根據實驗現象可知,改變溫度后化學平衡發生移動:升溫平衡向吸熱方向移動,降溫平衡向放熱反應方向移動,
故答案為:升溫平衡向吸熱方向移動,降溫平衡向放熱反應方向移動;
(4)該反應中,改變溫度后,容器內氣體的壓強也會改變,而壓強對該可逆反應同樣會產生影響,所以該實驗設計并不完全科學,
故答案為:壓強.
點評 本題考查了影響化學平衡的因素,題目難度中等,注意掌握溫度、壓強、濃度對因素對化學平衡的影響,試題側重考查學生的分析、理解能力及化學實驗能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ②③⑥ | C. | ②④⑤ | D. | ③⑤⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
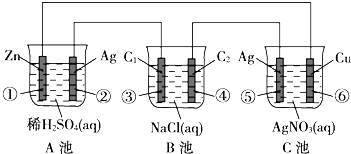 已知金屬活動性相差越大,形成原電池時越容易放電.請根據如圖裝置,回答下列問題:(其中C1、C2都為石墨電極)
已知金屬活動性相差越大,形成原電池時越容易放電.請根據如圖裝置,回答下列問題:(其中C1、C2都為石墨電極)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | m=$\frac{36.5V}{22.4}$ | B. | ω=$\frac{36.5c}{1000ρ}$ | ||
| C. | c=$\frac{1000ρV}{36.5V+22400}$ | D. | c=$\frac{V}{22.4+22.4V}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑥⑦ | B. | ②④⑤ | C. | ①③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某研究型學習小組為測定鎂和鋁的混合物中鋁的質量分數,稱取該樣品a g,溶于200mL 5mol/L HCl溶液中,共收集到標準狀況下的氫氣3.36L.
某研究型學習小組為測定鎂和鋁的混合物中鋁的質量分數,稱取該樣品a g,溶于200mL 5mol/L HCl溶液中,共收集到標準狀況下的氫氣3.36L.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶于水時,HI分子比HCl分子更容易電離 | |
| B. | HI比HCl熔、沸點都高 | |
| C. | HI比HCl更穩定 | |
| D. | 拆開相同物質的量的HI分子比HCl消耗的能量小,HI是離子化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
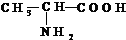 ,請回答下列問題.
,請回答下列問題. .
. 為:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.
為:CH2=CHCN、CH2=CHCH=CH2、CH2=CHC6H5.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com