
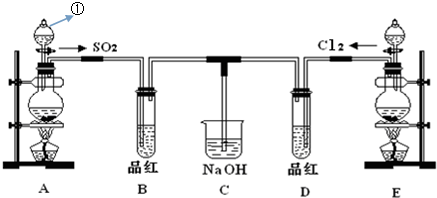
分析 裝置A是制備二氧化硫氣體的發生裝置,生成的二氧化硫具有漂白性,通入裝置B中品紅溶液褪色,裝置E是制備氯氣的發生裝置,生成的氯氣和水反應所處的次氯酸具有強氧化性,具有漂白性,通入品紅溶液褪色,剩余二氧化硫和氯氣被裝置C中氫氧化鈉溶液吸收,防止污染空氣,
(1)儀器①是添加溶液的分液漏斗;
(2)根據化學方程式書寫離子方程式,根據化合價的變化和轉移的電子數目計算生成氯氣標準狀況下的體積;
(3)SO2的漂白具有可逆性,次氯酸的漂白不可逆;
(4)裝置C中 氫氧化鈉可以吸收剩余的二氧化硫和氯氣;
(5)氯氣具有較強的氧化性,二氧化硫具有較強的還原性,在水溶液中兩者發生反應Cl2+SO2+2H2O═2HCl+H2SO4.
解答 解:(1)實驗室用裝置A制備SO2.其中儀器①的名稱是分液漏斗,
故答案為:分液漏斗;
(2)在反應MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,每有4mol HCl參與反應,被氧化的氯化氫是2mol,生成1molCl2電子轉移物質的量2mol,反應中當有0.4mol電子發生轉移時,產生的Cl2的物質的量為0.2mol,標準狀況下體積=0.2mol×22.4L/mol=4.48L,
故答案為:4.48;
(3)①SO2具有漂白性,二氧化硫通入品紅溶液中,品紅褪色,反應開始一段時間后,觀察到B、D兩個試管中的品紅溶液出現的現象是品紅溶液褪色,
故答案為:品紅褪色;品紅褪色;
②SO2的漂白具有可逆性,褪色后的溶液加熱時又恢復原來的紅色.氯氣和水反應生成的次氯酸具有漂白性,因而氯氣通入品紅溶液中也能使品紅褪色,次氯酸的漂白不可逆,加熱時,不能恢復紅色,
故答案為:褪色的品紅又恢復成紅色;無明顯現象;
(4)裝置C中 氫氧化鈉可以吸收剩余的二氧化硫和氯氣,防止污染氣體排放,
故答案為:除去多余的二氧化硫和氯氣;
(5)氯氣具有較強的氧化性,二氧化硫具有較強的還原性,在水溶液中兩者1:1發生反應:Cl2+SO2+2H2O═2HCl+H2SO4,生成物都無漂白性,因而SO2和Cl2按1:1同時通入到品紅溶液時,品紅溶液并不退色,
故答案為:Cl2+SO2+2H2O═2HCl+H2SO4.
點評 本題考查了氯氣和二氧化硫的漂白性質,注意掌握氯氣和二氧化硫性質,注意二氧化硫的漂白性與次氯酸的漂白性根本區別,題目難度中等.


 名題金卷系列答案
名題金卷系列答案 優加精卷系列答案
優加精卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 1L水中溶解了58.5g NaCl,該溶液的物質的量濃度為1mol/L | |
| B. | V L Fe2(SO4)3溶液中含a g SO42-,取此溶液0.5VL用水稀釋成2V L,則稀釋后溶液的c(Fe3+)為$\frac{a}{4V}$ mol/L | |
| C. | 實驗室需240mL2mol/L的CuSO4溶液,配置時應稱125.0gCuSO4•5H2O | |
| D. | 10mL質量分數為98%的H2SO4,用水稀釋至100mL,質量分數變為9.8% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯酚和甲醛在一定條件下可合成酚醛樹脂 | |
| B. | 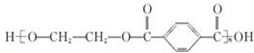 的單體是 HOCH2CH2OH 與 的單體是 HOCH2CH2OH 與  | |
| C. | 聚苯乙烯是由苯乙烯加聚生成的純凈物 | |
| D. | 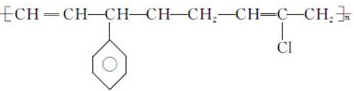 的單體有3種 的單體有3種 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在水溶液和熔融狀態下能導電的化合物,叫做電解質 | |
| B. | 在水溶液或熔融狀態下能導電的化合物,叫做電解質 | |
| C. | BaSO4是難溶物,所以是非電解質 | |
| D. | 氧化還原反應的本質是化合價升降 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 使用時電池負極區溶液的堿性增強 | |
| B. | 使用時電子由Ag2O極經外電路流向Zn極 | |
| C. | 溶液中OH-離子由正極向負極移動 | |
| D. | Zn電極發生還原反應,Ag2O電極發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 mol Na2O2和水完全反應,轉移電子數為2NA | |
| B. | 0.5 L 0.2 mol•L-1 FeCl3溶液中,含Fe3+數為0.1NA | |
| C. | 在一定條件下,催化分解80 g SO3,混合氣體中氧原子數為3NA | |
| D. | 常溫常壓下,28 g乙烯和丙烯混合氣體含有的碳原子總數為2.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溴水,燒堿溶液,濃H2SO4 | B. | 酸性KMnO4溶液,濃H2SO4 | ||
| C. | 澄清石灰水,濃H2SO4 | D. | 濃H2SO4,酸性KMnO4溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com