
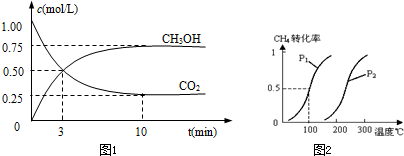
| 0.75mol/L |
| 10min |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |
| 0.2mol |
| 10L |
| 0.3mol |
| 10L |
| 0.01×0.033 |
| 0.01×0.02 |
| c(CO)?c3(H2) |
| c(CH4)?c(H2O) |


科目:高中化學 來源:不詳 題型:問答題
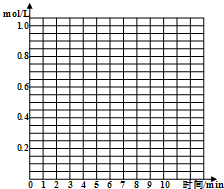
| t/min | CO/mol | H2/mol | Z/mol |
| 0 | 1.00 | 1.00 | 0.00 |
| 1 | 0.90 | 0.80 | 0.10 |
| 3 | 0.75 | 0.50 | 0.25 |
| 5 | 0.65 | 0.30 | 0.35 |
| 7 | 0.55 | 0.10 | 0.45 |
| 9 | 0.55 | 0.10 | 0.45 |
| 10 | 0.55 | 0.10 | 0.45 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
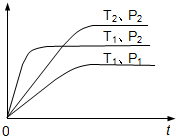
| A.a+b<c+d;△H<0 | B.a+b<c+d;△H>0 |
| C.a+b>c+d;△H>0 | D.a+b>c+d;△H<0 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
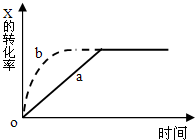
| A.升高溫度 | B.加大X的投入量 |
| C.增加N的量 | D.縮小容器的體積 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題

查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.1molCO+3molH2O(g) |
| B.1molCO+1molH2O |
| C.2molCO+4molH2O(g) |
| D.1molH2O(g)+1molCO2+1molH2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com