
| A.升高溫度 | B.加大X的投入量 |
| C.增加N的量 | D.縮小容器的體積 |
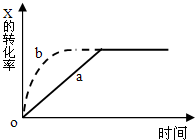
科目:高中化學 來源:不詳 題型:單選題
| A.①③④ | B.①④⑥ | C.②③⑥ | D.②③⑤ |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
 pD(g)+qE(s),△H<0(m、n、p、q為最簡整數比).
pD(g)+qE(s),△H<0(m、n、p、q為最簡整數比).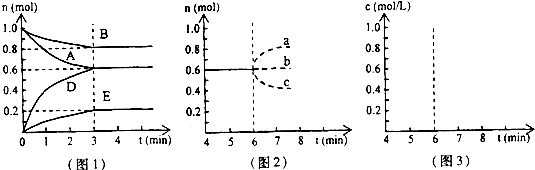
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
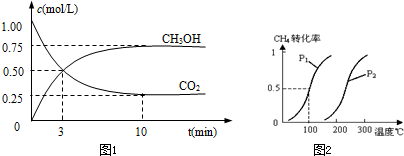
查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
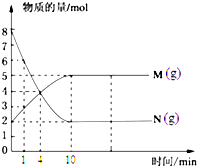
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| 起始狀態/mol | |||||||
| N2 | H2 | NH3 | |||||
| A | 2 | 0 | 2 | ||||
| B | 2.5 | 1.5 | 1 | ||||
| C |
| 2 |
| ||||
| D | 0 | 0 | 2 | ||||
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.達平衡后,隔板K最終停留在左側刻度0~2之間 |
| B.若平衡時K停留在左側1處,則活塞停留在右側6處 |
| C.達到平衡時,甲容器中B的物質的量小于于乙容器中B的物質的量 |
| D.根據隔板K滑動與否可判斷左右兩邊的反應是否達到平衡 |

查看答案和解析>>
科目:高中化學 來源:不詳 題型:問答題
| 溫度(K) CO2轉化率% n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
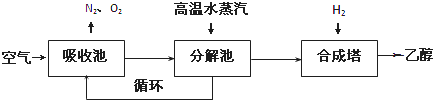
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.高溫、高壓 |
| B.適宜的溫度、高壓、催化劑 |
| C.低溫、高壓、催化劑 |
| D.高溫、高壓、催化劑 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com