

分析 本題是制備氮化鎂的實驗設計題,整個流程依次是先制取氨氣,利用溴氧化氨氣得氮氣,用氫氧化鈉溶液除揮發的溴,再用五氧化二磷干燥氮氣,最后在加熱的情況下鎂與氮氣反應生成氮化鎂;
(1)①整套裝置涉及到氣體的制備,因此需要檢驗裝置氣密性;
②因鎂帶也能與氧氣反應,因此需要提供無氧環境,避免副產物的生成;
(2)裝置A中a儀器是滴加濃氨水的,是分液漏斗;
(3)B中是用溴氧化氨氣制氮氣,同時生成溴化銨;
(4)可根據濃硫酸有強酸性及強氧化性,五氧化二磷遇水反應生成酸的性質來判斷
(5)E中是鎂帶在氮氣中燃燒生成氮化鎂;
(6)因氮化鎂極易水解,因此E裝置后要接一個干燥裝置,防空氣中的水汽進入;
(7)氮化鎂極易水解,生成氨氣和氫氧化鎂,水解產物再和稀鹽酸反應,固體中混有過量的鎂也能和鹽酸反應.
解答 解:(1)①制備氣體的裝置,需要檢驗裝置氣密性,故答案為:檢查裝置氣密性;
②為防止鎂帶與氧氣反應,因此需要通入惰性氣體,排出裝置中的空氣,提供無氧環境,避免副產物的生成,故答案為:通入惰性氣體,排出裝置中的空氣;
(2)裝置A中a儀器是分液漏斗,故答案為:分液漏斗;
(3)B中發生反應的化學方程式為3Br2+8NH3═6NH4Br+N2,故答案為:3Br2+8NH3═6NH4Br+N2;
(4)NH3能與酸反應,HI具有強還原性,故氮氣不能用濃硫酸干燥,也不能用五氧化二磷干燥,但HI不能用濃硫酸干燥,能用五氧化二磷干燥,CO2和SO2都可以用二者干燥,故答案為:b;
(5)E中發生反應的化學方程式為N2+3Mg$\frac{\underline{\;加熱\;}}{\;}$Mg3N2,故答案為:N2+3Mg$\frac{\underline{\;加熱\;}}{\;}$Mg3N2;
(6)為防止氮化鎂水解,在E裝置后要接一個干燥裝置,防空氣中的水汽進入,故答案為:在E裝置后,連接裝有堿石灰的干燥管,防止空氣中的水蒸汽進入E裝置;
(7)可看成氮化鎂遇水生成氨氣和氫氧化鎂,再和鹽酸繼續反應,另外過量的鎂也能和鹽酸反應,發生反應的化學方程式為Mg3N2+8HCl═2MgCl2+2NH4Cl、Mg+2HCl═MgCl2+H2↑,故答案為:Mg3N2+8HCl═2MgCl2+2NH4Cl;Mg+2HCl═MgCl2+H2↑.
點評 本題考查氨氣的制備與性質、鎂的性質及實驗的基本操作,綜合性比較強,但難度較低,重點考查基礎掌握情況.


 王后雄學案教材完全解讀系列答案
王后雄學案教材完全解讀系列答案 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:選擇題

| A. | W的原子序數可能是Y的兩倍 | |
| B. | Z的原子半徑比X的大 | |
| C. | Y元素的非金屬性比Z元素的強 | |
| D. | Z的最高價氧化物對應的水化物的酸性比W的強 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 儀器標號 | (1) | (2)(上) | (2)(下) | (3) | (4) | (5) |
| 試劑標號 | G | F |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
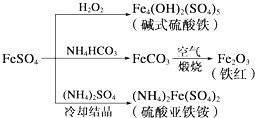
| A. | 制備堿式硫酸鐵利用了過氧化氫的氧化性 | |
| B. | 為防止NH4HCO3分解,生產FeCO3需在較低溫度下進行 | |
| C. | 可用KSCN溶液檢驗(NH4)2Fe(SO4)2是否被氧化 | |
| D. | 制備(NH4)2Fe(SO4)2利用了它的溶解度比FeSO4的溶解度大這一性質 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
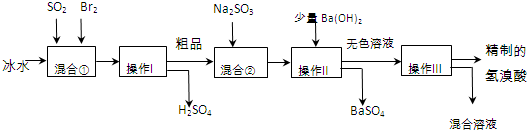
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
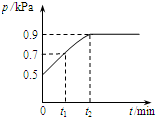 在1.0L密閉容器中放入0.1mol X,在一定溫度下發生反應:X(g)?Y(g)+Z(g)△H<0 容器內氣體總壓強p隨反應時間t的變化關系如圖所示.以下分析正確的是( )
在1.0L密閉容器中放入0.1mol X,在一定溫度下發生反應:X(g)?Y(g)+Z(g)△H<0 容器內氣體總壓強p隨反應時間t的變化關系如圖所示.以下分析正確的是( )| A. | t1時n(X)=0.04 mol | |
| B. | t1到t2,混合氣體的平均相對分子量增大 | |
| C. | 欲提高平衡體系中Y的含量,可升高體系溫度或減少Z的量 | |
| D. | 其他條件不變,再充入0.1 mol 氣體X,平衡正向移動,X的轉化率減少 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 因為SiO2是H2SiO3的酸酐,故SiO2溶于水得H2SiO3 | |
| B. | CO2通入水玻璃(Na2SiO3的水溶液)中可以得到硅酸沉淀 | |
| C. | 因為高溫時發生反應:Na2CO3+SiO2$\frac{\underline{\;高溫\;}}{\;}$Na2SiO3+CO2↑,所以硅酸的酸性比碳酸強 | |
| D. | SiO2是酸性氧化物,它不溶于任何酸 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com