
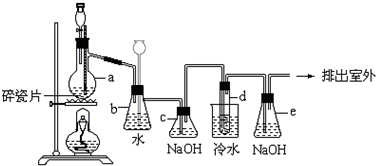
分析 (1)a為蒸餾燒瓶,乙醇在濃硫酸做催化劑、脫水劑條件下發生消去反應生成乙烯,必須注意反應溫度;
(2)乙烯與液溴發生加成反應生成1,2-二溴乙烷;
(3)依據當d堵塞時,氣體不暢通,則在b中氣體產生的壓強將水壓入直玻璃管中,甚至溢出玻璃管;
(4)c中的氫氧化鈉可以和制取乙烯中產生的雜質氣體二氧化碳和二氧化硫發生反應;
(5)根據乙烯與溴反應的利用率減少的可能原因進行解答;
(6)反應剩余的溴化氫、溴等有毒,能夠污染大氣,需要進行尾氣吸收,用e吸收.
解答 解:(1)裝置圖可知,儀器a為蒸餾燒瓶,乙醇在170℃時發生消去生成乙烯,溫度必須是170℃,反應方程式為:CH3CH2OH$→_{170℃}^{濃硫酸}$CH2=CH2↑+H2O,
故答案為:蒸餾燒瓶;CH3CH2OH$→_{170℃}^{濃硫酸}$CH2=CH2↑+H2O;
(2)乙烯與液溴發生加成反應生成1,2-二溴乙烷化學方程式為:CH2=CH2+Br2→CH2BrCH2Br,
故答案為:CH2=CH2+Br2→CH2BrCH2Br;
(3)試管d發生堵塞時,b中壓強不斷增大,會導致b中水面下降,玻璃管中的水柱上升,甚至溢出,
故答案為:b中水面會下降,玻璃管中的水柱會上升,甚至溢出;
(4)裝置c中盛有氫氧化鈉可以和制取乙烯中產生的雜質氣體二氧化碳和二氧化硫發生反應,
故答案為:吸收乙烯氣體中含有的CO2、SO2等酸性氣體;
(5)當溴全部褪色時,所消耗乙醇和濃硫酸混合液的量,比正常情況下超過許多的原因可能是乙烯發生(或通過液溴)速度過快,導致大部分乙烯沒有和溴發生反應;此外實驗過程中,乙醇和濃硫酸的混合液沒有迅速達到170℃會導致副反應的發生和副產物的生成,
故答案為:乙烯流速過快,未完全發生加成反應;實驗過程中,乙醇和濃硫酸的混合液沒有迅速達到170℃,發生副反應生成乙醚;
(6)該反應中剩余的溴化氫及反應副產物溴單質等有毒,會污染大氣,應該進行尾氣吸收,所以裝置e中氫氧化鈉溶液的作用是吸收HBr和Br2等氣體,防止大氣污染,
故答案為:吸收HBr和Br2等氣體,防止大氣污染.
點評 本題考查了制備實驗方案的設計、溴乙烷的制取方法,題目難度中等,注意掌握溴乙烷的制取原理、反應裝置選擇及除雜、提純方法,培養學生分析問題、理解能力及化學實驗能力.


科目:高中化學 來源: 題型:選擇題
| A. | 為防止鐵生銹,在其表面涂一層防銹油漆 | |
| B. | 為防止火災,在面粉廠、加油站等場所要嚴禁煙火 | |
| C. | 為加快KClO3的分解速率,加入MnO2 | |
| D. | 為提高H2O2的分解率,向溶液中滴加FeCl3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 在537℃、1.01×105Pa時,往容積可變的密閉容器中充入1mol X和3mol Y,此時容積為V L.保持恒溫恒壓,發生反應X(g)+3Y(g)?2Z(g),達到平衡時,平衡混合氣體中Z的體積分數為0.5.
在537℃、1.01×105Pa時,往容積可變的密閉容器中充入1mol X和3mol Y,此時容積為V L.保持恒溫恒壓,發生反應X(g)+3Y(g)?2Z(g),達到平衡時,平衡混合氣體中Z的體積分數為0.5.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學反應 | 平衡常數 | 溫度(℃) | |
| 500 | 800 | ||
| ①2H2(g)+CO(g)?CH3OH(g) | K1 | 2.5 | 0.15 |
| ②H2(g)+CO2(g)?H2O (g)+CO(g) | K2 | 1.0 | 2.50 |
| ③3H2(g)+CO2(g)?CH3OH(g)+H2O (g) | K3 | ||

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
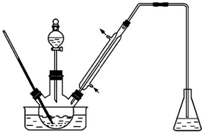 實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置如圖,相關物質的沸點見附表).
實驗室以苯甲醛為原料制備間溴苯甲醛(實驗裝置如圖,相關物質的沸點見附表).| 物質 | 沸點/℃ | 物質 | 沸點/℃ |
| 溴 | 58.8 | 1,2-二氯乙烷 | 83.5 |
| 苯甲醛 | 179 | 間溴苯甲醛 | 229 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
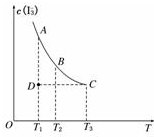 實驗室將I2溶于KI溶液中,配制濃度較大的碘水,主要是因為發生了反應:I2(aq)+I-(aq)?I3-(aq),上述平衡體系中,I3-的物質的量濃度c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態),下列說法不正確的是( )
實驗室將I2溶于KI溶液中,配制濃度較大的碘水,主要是因為發生了反應:I2(aq)+I-(aq)?I3-(aq),上述平衡體系中,I3-的物質的量濃度c(I3-)與溫度T的關系如圖所示(曲線上的任何一點都表示平衡狀態),下列說法不正確的是( )| A. | 該反應的正反應是吸熱反應 | B. | A點與C點的化學反應速率vA<vC | ||
| C. | 在反應進行到D點時,v正>v逆 | D. | A點與B點相比,B點的c(I2)大 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 弱堿性溶液中:Na+、K+、Cl-、HCO3- | |
| B. | “84”消毒液中:SiO32-、CO32-、Na+、S2- | |
| C. | 使酚酞變紅色的溶液中:Na+、Al3+、SO42-、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、SCN-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com