
【題目】設NA為阿伏加德羅常數的數值,下列說法不正確的是
A. 23g Na與O2充分反應生成Na2O和Na2O2的混合物,消耗O2的分子數N(O2)的范圍為:0.25 NA< N(O2)< 0.5 NA
B. 2 mol NO和1 mol O2在密閉容器中充分反應,反應后容器中的分子數小于2NA
C. 2.5gMg-Zn合金與足量鹽酸反應,放出的氣體在標況下的體積可能為2.24L
D. 50 mL 18.4 mol/L濃硫酸與足量銅微熱反應,轉移的電子數目為0.92NA
【答案】D
【解析】
A.23g Na物質的量為1mol,根據4Na+O2=2Na2O反應可知,消耗N(O2)=0.25NA;根據2Na+O2=Na2O2反應可知,消耗N(O2)=0.5NA;因此1molNa與O2充分反應生成Na2O和Na2O2的混合物,消耗O2的分子數N(O2)的范圍為:0.25 NA< N(O2)< 0.5 NA,A正確;
B. 在密閉容器中發生反應:2NO+O2=2NO2,所以2molNO和1molO2反應生成2molNO2,由于2NO2![]() N2O4反應的存在,所以反應后容器中的分子數小于2NA,B正確;
N2O4反應的存在,所以反應后容器中的分子數小于2NA,B正確;
C. 設Mg為xmol,Zn為ymol,放出的氣體的量為0.1mol,則24x+65y=2.5,x+y=0.1,則x=4/41mol,y=0.1/41mol,所以當n(Mg):n(Zn)=40:1時,放出的氣體在標況下的體積可能為2.24L;C正確;
D.濃硫酸與足量的銅微熱反應,隨著反應的進行,濃硫酸變為稀硫酸,反應停止;因此50 mL18.4 mol/L濃硫酸不能全部反應,因此轉移的電子數目小于0.92NA,D錯誤;
綜上所述,本題選D。


 教材全解字詞句篇系列答案
教材全解字詞句篇系列答案科目:高中化學 來源: 題型:
【題目】下列現象或新技術應用中,不涉及膠體性質的是( )
①在飽和氯化鐵溶液中逐滴加入NaOH溶液,產生紅褐色沉淀
②使用微波手術刀進行外科手術,可使開刀處的血液迅速凝固而減少失血
③清晨,在茂密的樹林中,常常可以看到從枝葉間透過的一道道光柱
A.只有①B.①和②
C.②和③D.全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳鎘(Ni—Cd)可充電電池在現代生活中有廣泛應用。已知某鎳鎘電池的電解質溶液為KOH溶液,其充、放電按下式進行:Cd+2NiOOH+2H2O![]() Cd(OH)2+2Ni(OH)2。有關該電池的說法正確的是( )
Cd(OH)2+2Ni(OH)2。有關該電池的說法正確的是( )
A. 放電時負極失去電子,發生還原反應
B. 放電時電解質溶液中的OH-向正極移動
C. 充電時陰極附近溶液的pH減小
D. 充電時陽極反應:Ni(OH)2-e-+OH-===NiOOH+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】分類法是一種行之有效、簡單易行的科學方法,人們在認識事物時可以采取多種分類方法。下列關于“Na2CO3”的分類不正確的是 ( )
A.電解質B.碳酸鹽C.鈉鹽D.堿
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)NH3經一系列反應可以得到HNO3和NH4NO3,如圖所示,

在Ⅰ中,NH3和O2在催化劑作用下反應,其化學方程式是:__________________________

(2)Ⅱ中,2NO(g)+ O2(g) 2NO2(g).在其他條件相同時,分別測得NO的平衡轉化率在不同壓強(p1、p2)下溫度變化的曲線(如圖).
①p1、p2的大小關系p1 ________ p2(填大于、等于、小于) .
②隨溫度升高,該反應平衡常數變化的趨勢是_________________________
(3)Ⅲ中,降低溫度,將NO2(g)轉化為N2O4(1)再制備濃硝酸.
N2O4與O2, H2O化合的化學方程式是______________________________
(4)Ⅳ中,電解NO制備NH4NO3,其原理原理如下圖所示,為使電解產物全部轉化為NH4NO3, 需補充物質___________ ,說明理由:___________________.
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置能達到實驗目的的是
A. 用如裝置將氯化鐵溶液直接蒸干得到氯化鐵固體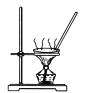
B. 用如圖裝置制備Fe(OH)2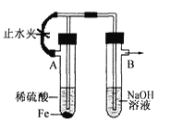
C. 用如圖裝置除去CO2中含有的少量HCl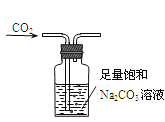
D. 用如圖裝置配制100mL 0.1mol/L的稀硫酸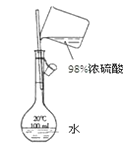
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Ⅰ.納米級Cu2O既是航母艦艇底部的防腐蝕涂料,也是優良的催化劑。
(1)已知:C(s)+![]() O2(g)=CO(g)ΔH =–110.4kJmol-1,
O2(g)=CO(g)ΔH =–110.4kJmol-1,
2Cu2O(s)+O2(g)= 4CuO(s) ΔH =–292kJmol-1,則工業上用碳粉與CuO粉末混合在一定條件下反應制取Cu2O(s),同時生成CO氣體的熱化學方程式為________。
(2)用納米級Cu2O作催化劑可實現甲醇脫氫制取甲醛:
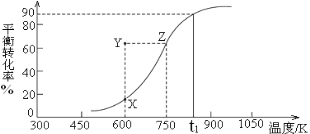
CH3OH(g)![]() HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如右圖所示。
HCHO(g)+H2(g),甲醇的平衡轉化率隨溫度變化曲線如右圖所示。
①該反應的ΔH___0 (填“>”或“<”);600K時,Y點甲醇的v(正) ____v(逆)(填“>”或“<”)。
②從Y點到X點可采取的措施是___________________________________。
③在t1K時,向固定體積為2L的密閉容器中充入1molCH3OH(g),溫度保持不變,9分鐘時達到平衡,則0~9min內用CH3OH(g)表示的反應速率v(CH3OH)=_____________, 溫度為t1時,該反應的平衡常數K=____________。
Ⅱ.金屬銅因導電性強而應用廣泛。
由黃銅礦冶煉得到的粗銅經過電解精煉才能得到純銅。電解時,粗銅作______極,陰極的電極反應式為_______________。
Ⅲ.含銅離子的的廢水會造成污染,通常將其轉化為硫化銅沉淀而除去。
已知:Ksp[CuS]=1×10-36,要使銅離子的濃度符合排放標準(不超過0.5mg/L),溶液中的硫離子的物質的量濃度至少為__________mol/L(保留至小數點后一位)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】Licht等科學家設計的Al—MnO4—電池原理如圖所示,電池總反應為Al+MnO4—===AlO2—+MnO2,下列說法正確的是( )
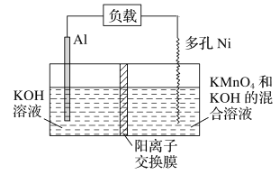
A. 電池工作時,K+向負極區移動
B. Al電極發生還原反應
C. 正極的電極反應式為MnO4—+4H++3e-===MnO2+2H2O
D. 理論上電路中每通過1mol電子,負極質量減小9g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在標準狀況下,將a L NH3完全溶于水得到V mL氨水,溶液的密度為ρ g/cm3,溶質的質量分數為ω,溶質的物質的量濃度為C mol/L。下列敘述中正確的有( )
①![]()
②![]()
③上述溶液中加入V mL水后,所得溶液的質量分數大于0.5ω
④上述溶液中再加入1.5V mL同濃度稀鹽酸,充分反應后溶液中離子濃度大小關系為:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
A. ②③ B. ②④ C. ③④ D. ①③
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com